Substancje perfluoroalkilowe (PFAS)
Substancje perfluoroalkilowe (PFAS) — grupa syntetycznych związków organicznych o ogólnym wzorze CₙF₂ₙ₊₁R, składających się z łańcucha perfluoroalkilowego (CₙF₂ₙ₊₁) i grupy funkcyjnej (R), np. grupy karboksylowej (–COOH), grupy sulfonowej (–SO₃H). Większość PFAS stanowią ciała stałe w postaci bezbarwnych kryształów lub białego proszku; niektóre związki o krótkich łańcuchach perfluoroalkilowych są bezbarwnymi cieczami. PFAS charakteryzują się wysoką stabilnością chemiczną i termiczną. PFAS określane są mianem „wiecznych chemikaliów” ze względu na trwałość oraz tendencję do akumulacji w środowisku i łańcuchach pokarmowych. Są toksyczne; powodują uszkodzenia wątroby, osłabienie odporności, zaburzenia płodności, przyczyniają się do rozwoju nowotworów. PFAS stosowane są w wielu gałęziach przemysłu (np. przemyśle chemicznym, tekstylnym, spożywczym, budowlanym i elektronicznym).
Występowanie PFAS w przyrodzie
Substancje perfluoroalkilowe (PFAS) stanowią liczną grupę syntetycznych związków fluoroorganicznych (ok. 5 tys.) występujących w środowisku przyrodniczym (np. wodach powierzchniowych i podziemnych, glebach, organizmach żywych). Ich obecność w przyrodzie nie jest jednak wynikiem procesów naturalnych, lecz wiąże się z bytowaniem i działalnością człowieka. Główne źródła emisji substancji perfluroalkilowych do środowiska stanowią zakłady przemysłowe (np. zakłady chemiczne, fabryki tekstyliów, rafinerie ropy naftowej), składowiska odpadów komunalnych i przemysłowych oraz zakłady oczyszczania ścieków.
PFAS są trwałymi zanieczyszczeniami organicznymi (TZO) określanymi mianem „wiecznych chemikaliów”, co wynika ze stabilności struktury chemicznej ich cząsteczek i odporności na naturalne procesy rozkładu. Substancje te mają więc tendencję do akumulacji w środowisku (glebach, wodach powierzchniowych) oraz wodnych i lądowych łańcuchach pokarmowych; mogą również przenikać do wody pitnej i żywności. Lotne PFAS często rozprzestrzeniają się wraz z masami powietrza, przyczyniając się do zanieczyszczenia obszarów położonych w dużej odległości od źródła emisji, np. w wyniku opadów atmosferycznych (tzw. depozycja mokra).
Właściwości fizyczne PFAS
Większość substancji perfluoroalkilowych (PFAS) stanowią ciała stałe w postaci bezbarwnych kryształów lub drobnego białego proszku; niektóre związki o krótkich łańcuchach alkilowych są bezbarwnymi cieczami. Gęstość PFAS wynosi z reguły 1,80-1,85 g/cm³. Związki te cechują się zróżnicowaną rozpuszczalnością w wodzie; niektóre, np. kwas perfluorooktanowy (PFOA) jest bardzo dobrze rozpuszczalny (9.5 x 103 mg/dm³ H₂O w temp. 25°C); inne, jak np. kwas perfluorooktanosulfonowy (PFOS) ma mniejszą rozpuszczalność w wodzie (550 mg/dm³ H₂O w temp. 25°C). Wiele PFAS stanowią substancje powierzchniowo czynne obniżające napięcie powierzchniowe wody dzięki zmniejszaniu sił kohezji (spójności) między jej cząsteczkami.
PFAS cechują się z reguły niską prężnością par – są więc substancjami o niewielkiej lotności; np. dla kwasu perfluorooktanowego (PFOA) prężność par wynosi 0,525 mm Hg, dla kwasu perfluorooktanosulfonowego (PFOS) – 0,002 mm Hg. Niektóre PFAS są substancjami lotnymi (alkohole fluorotelomerowe, FTOH); prężność par tych związków wynosi 1,08-7,44 mm Hg. Temperatury topnienia i wrzenia PFAS rosną wraz z długością łańcucha perfluoroalkilowego, np. dla kwasu perfluorooktanowego (PFOA) wynoszą odpowiednio 40-50°C i 189-192°C; zaś dla kwasu perfluorodekanowego (PFDA) – 77-81°C i 218°C. PFAS są związkami o wysokiej stabilności termicznej i nie ulegają rozkładowi w temperaturach niższych niż 400-500°C.

Bezbarwne kryształki kwasu perfluorooktanowego (PFOA). Źródło: North747, CC BY-SA 4.0, via Wikimedia Commons
Budowa i właściwości chemiczne PFAS
Substancje perfluoroalkilowe (PFAS, ang. perfluoroalkyl substances) są grupą syntetycznych związków organicznych o ogólnym wzorze sumarycznym CₙF₂ₙ₊₁R, składających się z dwóch głównych komponentów – łańcucha perfluoroalkilowego (CₙF₂ₙ₊₁), czyli łańcucha alkilowego (węglowego) z przyłączonymi atomami fluoru, oraz charakterystycznej grupy funkcyjnej (R). PFAS są związkami amfifilowymi (amfipatycznymi) wykazującymi jednocześnie właściwości hydrofobowe („odpychające wodę”) i lipofobowe („odpychające lipidy”) dzięki obecności niepolarnych łańcuchów perfluoroalkilowych oraz właściwości hydrofilowe („przyciągające wodę”) dzięki obecności polarnych grup funkcyjnych o dużym momencie dipolowym.
Substancje perfluoroalkilowe (PFAS) zróżnicowane są na cztery główne rodzaje w zależności od grupy funkcyjnej występującej w ich cząsteczkach:
- anionowe – zawierające kwasowe grupy funkcyjne dysocjujące w roztworze wodnym z wytworzeniem anionów; np. grupy karboksylowe (–COOH), sulfonowe (–SO₃H), siarczanowe (–SO₄), fosforanowe (–PO₄);
- kationowe – zawierające zasadowe grupy funkcyjne dysocjujące w roztworze wodnym z wytworzeniem kationów; np. grupy aminowe (–NH₂);
- obojnacze – zawierające kwasowe i zasadowe grupy funkcyjne dysocjujące w roztworze wodnym z wytworzeniem anionów lub kationów (w zależności od pH);
- niejonowe – zawierające grupy funkcyjne nie ulegające dysocjacji w roztworze wodnym, np. grupy hydroksylowe (–OH);
Substancje perfluoroalkilowe (PFAS) powstają głównie w procesie elektrochemicznego fluorowania związków organicznych (np. fluorków kwasów karboksylowych) w obecności bezwodnego fluorku wodoru (ECS, ang. electrochemical fluorination):
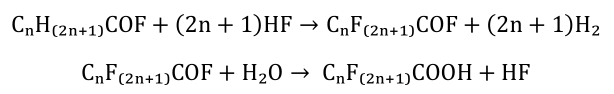
PFAS mogą być również otrzymywane w procesie telomeryzacji polegającej na wytworzeniu liniowego łańcucha telomerów w wyniku reakcji telogenu (jodku perfluoroalkilu) z jedną lub większą ilością cząsteczek ulegających polimeryzacji (taksogenów) (np. tetrafluoroetylenu). Powstałe telomery są następnie utleniane do kwasów perfluorokarboksylowych (PFCA).
Substancje perfluoroalkilowe, np. kwasy perfluorokarboksylowe (PFCA, ang. perfluoroalkyl carboxylic acid) i kwasy perfluorosulfonowe (PFSA, ang. perfluorosulphonic acid), wykazują wysoką stabilność chemiczną i odporność na procesy degradacji (np. hydrolizę, utlenianie, redukcję). Powyższe właściwości warunkowane są obecnością silnych wiązań kowalencyjnych pomiędzy atomami węgla i fluoru (C– F) w łańcuchu perfluoroalkilowym, których trwałość wynika w głównej mierze z niewielkiej długości wiązania i dużej różnicy elektroujemności między atomami. Grupy funkcyjne PFAS są z kolei podatne na szereg przemian chemicznych.
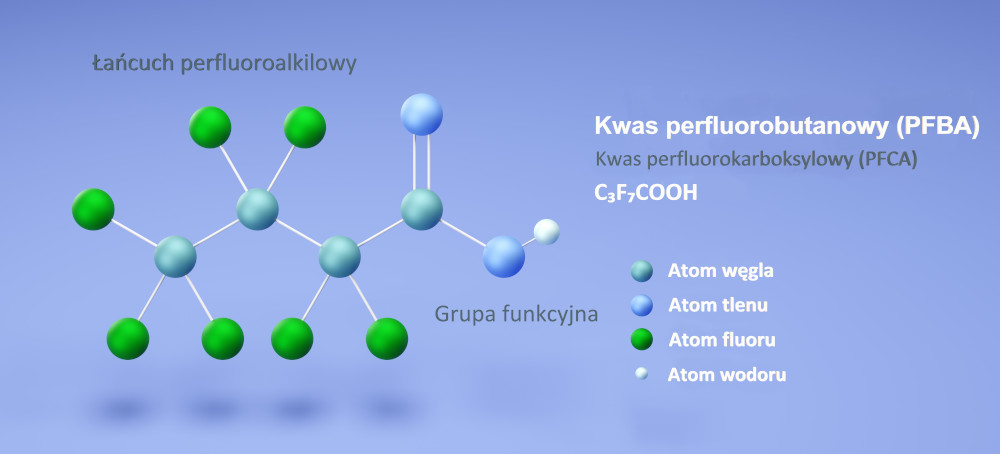
Budowa substancji perfluoroalkilowych (PFAS) na przykładzie kwasu perfluorobutanowego (PFBA). Autor: SergeiShimanovich//shutterstock.com
Znaczenie biologiczne PFAS
Substancje perfluoroalkilowe (PFAS) są substancjami szkodliwymi dla organizmów żywych, przyczyniającymi się do zaburzenia równowagi hormonalnej, prawidłowego funkcjonowania narządów wewnętrznych (np. wątroby) i układów narządów (np. układu odpornościowego, układu nerwowego). Niektóre substancje wykazują działanie kancerogenne (rakotwórcze). PFAS po dostaniu się do wnętrza organizmu ulegają akumulacji w osoczu krwi, wątrobie lub nerkach; w mniejszych ilościach obecne są również w tkankach (np. tkance mięśniowej).
Główne źródła narażenia na substancje perfluoroalkilowe (PFAS) obejmują:
- spożywanie wody pitnej (np. wody wodociągowej), wody gazowanej i napojów zawierających PFAS (np. herbaty w torebkach, soków owocowych);
- spożywanie produktów żywnościowych zanieczyszczonych PFAS (np. przetworów mięsnych, ryb, jaj, owoców, warzyw i przetworów owocowo-warzywnych);
- korzystanie z produktów zawierających PFAS (np. opakowań do żywności, tekstyliów, naczyń kuchennych, kosmetyków, środków czyszczących);
- wdychanie pyłów, aerozoli i oparów skażonych PFAS (np. w zakładach chemicznych produkujących związki fluoroorganiczne).
Niekorzystne skutki zdrowotne spowodowane obecnością substancji perfluroalkilowych (PFAS) w organizmie obejmują:
- układ hormonalny – zaburzenie pracy hormonów tarczycy i hormonów rozrodczych (estrogenów, androgenów); nieregularne cykle miesiączkowe, obniżenie płodności;
- wątroba – uszkodzenie wątroby, zapalenie wątroby, zaburzenia metabolizmu cholesterolu (hipercholesterolemia), zwłóknienie wątroby;
- układ odpornościowy – osłabienie odporności i wzrost podatności na infekcje; choroby autoimmunologiczne (np. wrzodziejące zapalenie jelita grubego);
- nowotwory – zwiększone ryzyko rozwoju chłoniaków nieziarniczych, nowotworów złośliwych nerki, prostaty i jąder.
Ekspozycja na PFAS może być również związana ze zwiększonym ryzykiem występowania zaburzeń w przebiegu ciąży (np. nadciśnienie ciążowe, stany przedrzucawkowe, poronienie, przedwczesny poród) i niekorzystnie wpływać na rozwój nienarodzonego dziecka (np. niska masa urodzeniowa, zaburzenia rozwoju układu nerwowego i układu odpornościowego).

Zastosowania substancji perfluoroalkilowych (PFAS). Autor: Francesco Scatena/shuttertock.com
Zastosowania PFAS
Substancje perfluoroalkilowe (PFAS) wykorzystywane są powszechnie w wielu gałęziach przemysłu – przemyśle chemicznym (np. produkcja politetrafluoroetylenu, PTFE; produkcja pianki gaśniczej), przemyśle tekstylnym (np. produkcja odzieży wodoodpornej), przemyśle spożywczym (np. produkcja opakowań do przechowywania produktów żywnościowych), przemyśle budowlanym (np. produkcja lakierów, farb, uszczelniaczy, materiałów izolacyjnych) i przemyśle elektronicznym (np. produkcja półprzewodników). PFAS mają także zastosowanie w produkcji wielu przedmiotów codziennego użytku, takich jak środki czyszczące, środki do impregnacji, kosmetyki i produkty do pielęgnacji ciała (np. chusteczki higieniczne, papier toaletowy, nici dentystyczne, szampony, lakiery do paznokci, tusze do rzęs, róże, szminki, balsamy do ust), naczynia kuchenne z nieprzywierającymi powłokami (np. patelnie, garnki), tekstylia domowe odporne na zabrudzenia (np. dywany, wykładziny dywanowe, tapicerki).
Bibliografia:
- Chemia organiczna, John McMurry, Wydawnictwo Naukowe PWN, Warszawa 2005.
- Chemia środowiska, Gary W. VanLoon, Stephen J. Duffy, Wydawnictwo Naukowe PWN, Warszawa 2007.
- Chemistry of the Elements (2nd ed.), Norman Neill Greenwood, Alan Earnshaw, Butterworth-Heinemann, Oxford 1997.
- Chemistry³. Introducing inorganic, organic and physical chemistry, Andrew Burrows, John Holman, Andrew Parsons, Gwen Pilling, Gareth Price, Oxford University Press, 2017.
- Nowoczesne kompendium chemii, -H. Lautenschlager, W. Schroter, A. Wanninger, Wydawnictwo Naukowe PWN, Warszawa 2016.
- Podręczny słownik chemiczny, Romuald Hassa, Janusz Mrzigod, Janusz Nowakowski, Videograf II, Katowice 2004.





