fenol
Fenol, benzenol — Fenol, hydroksybenzen, benzenol (C₆H₅OH) – organiczny związek chemiczny z grupy fenoli monohydroksylowych, składający się z sześcioczłonowego pierścienia utworzonego z atomów węgla (pierścienia benzenowego) i przyłączonej bezpośrednio do niego grupy hydroksylowej (–OH). Fenol jest bezbarwnym ciałem stałym o strukturze krystalicznej, przyjmującym pod wpływem częściowego utleniania jasnoróżowe lub brunatne zabarwienie. Dobrze rozpuszcza się w rozpuszczalnikach organicznych; słabiej rozpuszcza się w wodzie. Ma charakter słabego kwasu; reaguje z wodorotlenkami metali alkalicznych tworząc sole zwane fenolanami. Fenol ulega ponadto reakcjom estryfikacji, eteryfikacji i substytucji elektrofilowej. Jest substancją toksyczną, wywołującą podrażnienia skóry i błon śluzowych. Wykorzystywany jest w produkcji tworzyw sztucznych, włókien syntetycznych, herbicydów, fungicydów i leków (np. aspiryny).
Występowanie fenolu w przyrodzie
Fenol jest organicznym związkiem chemicznym występującym naturalnie w przyrodzie jako jeden ze składników smoły węglowej powstałej w wyniku odgazowania węgla kamiennego bądź kreozotu drzewnego utworzonego w wyniku degradacji biomasy roślinnej pod wpływem wysokiej temperatury. Fenol obecny jest również w rozkładającej się materii organicznej oraz w zbędnych produktach przemiany materii wydalanych przez zwierzęta i człowieka (odpadach metabolicznych). Może być ponadto uwalniany do środowiska w wyniku pożarów lasów bądź fotodegradacji benzenu atmosferycznego. Obecność fenolu w przyrodzie wiąże się w dużej mierze także z działalnością człowieka; do jego emisji przyczyniają się procesy przemysłowe (np. rafinacja ropy naftowej, produkcja paliw ciekłych i gazowych oraz koksu metalurgicznego z węgla) bądź wycieki z zakładów przetwarzania odpadów komunalnych. Fenol został odkryty w smole węglowej przez niemieckiego chemika Friedlieba Ferdinanda Rungego w 1832 roku.
Właściwości fizyczne fenolu
Fenol w temperaturze pokojowej jest bezbarwnym ciałem stałym o strukturze krystalicznej, przyjmującym pod wpływem częściowego utleniania na powietrzu jasnoróżowe lub brunatne zabarwienie. Posiada intensywny i słodkawy zapach, drażniący błony śluzowe. Fenol bardzo dobrze rozpuszcza się w rozpuszczalnikach organicznych (np. etanolu, glicerolu, chloroformie, eterze etylowym, benzenie). Jest słabo rozpuszczalny w zimnej wodzie (8,28 g/100 cm³ wody w temp. 20°C); rozpuszczalność fenolu w wodzie rośnie jednak wraz z temperaturą i powyżej 68,8°C związek ten jest mieszalny z wodą w dowolnych proporcjach. Fenol jest substancją palną o temperaturze zapłonu wynoszącej 79°C i temperaturze samozapłonu równej 605°C.
Gęstość fenolu w stanie stałym wynosi 1,07 g/cm³ (w temp. 20°C); jest więc cięższy od wody (0,998 g/cm³), w związku z czym opada pod jej powierzchnię. Fenol topi się w temperaturze 41°C (1013,25 hPa) i ulega wrzeniu w temperaturze 182°C (1013,25 hPa). Przy temperaturach wyższych od temperatury topnienia (> 41°C) fenol skrapla się, przechodząc w bezbarwną lub różową ciecz o gęstości równej 1,058 g/cm³. Przy temperaturach wyższych od temperatury wrzenia (> 182°C) fenol tworzy bezbarwne pary o gęstości wynoszącej 4,19 g/cm³, ponad trzykrotnie cięższe od otaczającego powietrza (1,293 g/cm³). Mieszanina oparów fenolu z powietrzem zawierająca 0,3-2,4 % obj. fenolu cechuje się właściwościami wybuchowymi.

Fenol jest bezbarwnym ciałem stałym o strukturze krystalicznej. Źródło: Bartłomiej Bulicz, CC BY-SA 3.0, via Wikimedia Commons
Budowa i właściwości chemiczne fenolu
Fenol (C₆H₅OH), określany także mianem hydroksybenzenu lub benzenolu, jest organicznym związkiem chemicznym o masie molowej równej 94,11 g/mol, zaliczanym do grupy fenoli monohydroksylowych. Cząsteczka fenolu jest płaska; zbudowana jest z sześcioczłonowego pierścienia z atomów węgla (pierścienia benzenowego) i przyłączonej bezpośrednio do niego grupy hydroksylowej (–OH). Długość wiązania węgiel-tlen (C–O) w cząsteczce fenolu wynosi 136 µm; jest więc nieco mniejsza niż długość analogicznego wiązania w cząsteczkach alkoholi alifatycznych (142 µm). Skrócenie wiązania wynika w głównej mierze ze sprzężenia wolnej pary elektronowej na atomie tlenu z sekstetem elektronowym pierścienia aromatycznego.
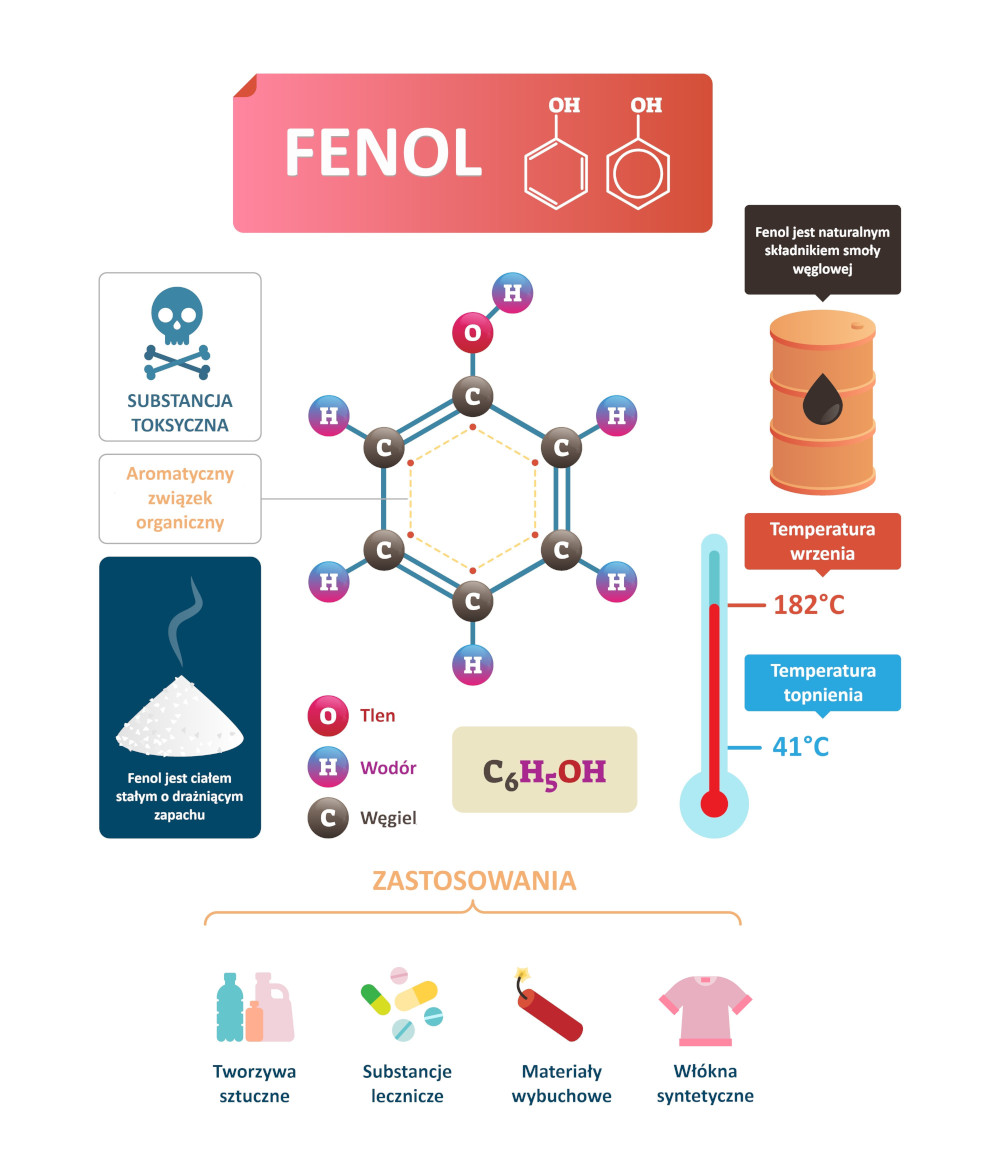
Budowa, właściwości i zastosowania fenolu. Autor: VectorMine/shutterstock.com
Fenol otrzymywany jest z wykorzystaniem następujących metod i reakcji chemicznych:
- metoda kumenowa – otrzymywanie izopropylobenzenu (kumenu), (CH₃)₂–CH–C₆H₅ w reakcji alkilowania benzenu (C₆H₆) propenem (CH₃CH=CH₂) w obecności chlorku glinu (AlCl₃); utlenianie kumenu do wodoronadtlenku kumenu (C₆H₅–C(CH₃)₂OOH); rozkład wodoronadtlenku kumenu do fenolu (C₆H₅OH) i acetonu (CH₃–CO−CH₃):

- hydroliza chlorobenzenu (C₆H₅Cl) przy użyciu wodorotlenku sodu (NaOH) w wysokiej temperaturze (200-250°C) i ciśnieniu (2-5 MPa); zakwaszanie otrzymanego fenolanu sodu (C₆H₅ONa) do fenolu (C₆H₅OH):

- stapianie kwasu benzenosulfonowego (C₆H₅SO₃H) lub benzenosulfonianu sodu (C₆H₅SO₃Na) z wodorotlenkiem sodu (NaOH) i zakwaszanie otrzymanego fenolanu sodu (C₆H₅ONa) do fenolu (C₆H₅OH):

- zagotowanie roztworu soli diazoniowej (np. aniliny, C₆H₅NH₂) w obecności kwasu solnego (HCl) i azotanu (III) sodu (NaNO₂):
![]()
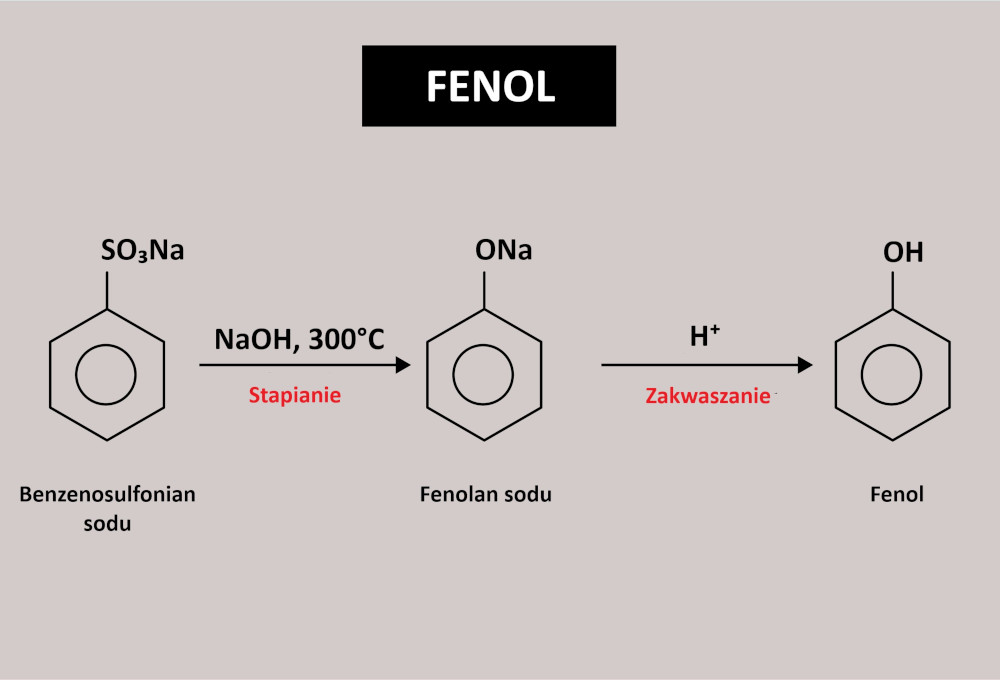
Otrzymywanie fenolu. Autor: Jaya Bharathi A/shutterstock.com
Fenole wykazują wyraźnie zaznaczone właściwości kwasowe, co stanowi cechę odróżniającą te związki od alkoholi alifatycznych. Większa kwasowość fenoli wynika z większej polaryzacji wiązania O–H, będącej konsekwencją bezpośredniego połączenia grupy hydroksylowej (–OH) z pierścieniem (sprzężenia wolnej grupy elektronów atomu tlenu z sekstetem elektronowym).
Fenol w roztworze wodnym zachowuje się jak bardzo słaby kwas (pH 6,6); związek ten ulega dysocjacji z wytworzeniem anionu fenolanowego (C₆H₅O⁻) i kationu hydroniowego (H₃O⁺):
![]()
Fenol reaguje z wodorotlenkami metali alkalicznych (np. wodorotlenkiem sodu, NaOH) tworząc rozpuszczalne w wodzie sole (fenolany) (np. fenolan sodu, C₆H₅ONa):
![]()
Fenol reaguje z chlorkami kwasowymi (np. chlorkiem acetylu, CH₃COCl) lub bezwodnikami kwasowymi (np. bezwodnikiem octowym, (CH₃CO)₂O) tworząc odpowiednie estry arylowe np. octan fenylu (CH₃COOC₆H₅):

Fenol reaguje z siarczanem dimetylu (CH₃)₂SO₄ lub diazometanem (CH₂N₂) z wytworzeniem eterów mieszanych alifatyczno-aromatycznych (np. anizolu, C₆H₅OCH₃):

Fenol bardzo łatwo ulega reakcjom substytucji elektrofilowej (np. bromowaniu, nitrowaniu), co spowodowane jest silną aktywacją pierścienia aromatycznego przez grupę hydroksylową (– OH). Reakcje substytucji elektrofilowej fenolu prowadzą do przyłączenia większej ilości podstawników, kierowanych przez aktywującą grupę –OH w pozycje orto (2,6) i para (4).
- bromowanie – reakcja podstawienia atomów wodorów pierścienia benzenowego przez atomy bromu (Br) prowadzącą do powstania 2,4,6-tribromofenolu (Br)₃C₆H₂OH:
![]()
- nitrowanie – reakcja podstawienia atomów wodoru pierścienia przez grupę nitrową (–NO₂) przy udziale rozcieńczonego kwasu azotowego (V) (HNO₃) (20 %) prowadząca do powstania mieszaniny 2(orto)-nitrofenolu i 4(para)-nitrofenolu (NO₂C₆H₄OH):
![]()
Reakcja nitrowania fenolu przy udziale stężonego kwasu azotowego (V) (HNO₃) (68%) prowadzi do utworzenia 2,4,6-trinitrofenolu (NO₂)₃C₆H₂OH z dwiema grupami – NO₂ położonymi w pozycji orto i jedną grupą –NO₂ w pozycji para względem grupy –OH.
![]()
- alkilowanie – reakcja podstawienia atomu wodoru pierścienia benzenowego przez grupę alkilową halogenku alkilu (np. chlorometanu, CH₃Cl) prowadząca do powstania mieszaniny 2-metylofenolu (o-krezolu) i 4-metylofenolu (p-krezolu) (CH₃C₆H₄OH):
![]()
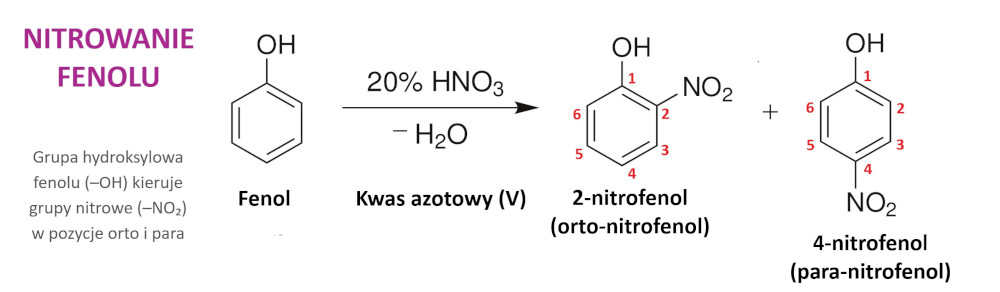
Nitrowanie fenolu przy udziale rozcieńczonego kwasu azotowego (V) prowadzi do powstania mieszaniny orto-nitrofenolu i para-nitrofenolu. Autor: Mrug
Reakcją charakterystyczną dla fenoli, umożliwiającą wykrywanie tych związków chemicznych na potrzeby analizy chemicznej, jest reakcja kompleksowania przy użyciu chlorku żelaza (III) (FeCl₃) o pomarańczowej barwie. Tworząca się w wyniku tej reakcji sól kompleksowa, czyli fenolan (III) żelaza Fe(C₆H₅O)₃, posiada intensywną, fioletową lub ciemnogranatową barwę.
Znaczenie biologiczne fenolu
Fenol jest jednym ze związków chemicznych powstających naturalnie w procesie rozkładu szczątków roślinnych i zwierzęcych; jest również składnikiem odpadów metabolicznych wydalanych z organizmów zwierząt i człowieka. Fenol wykorzystywany jest przez bakterie beztlenowe Cryptanaerobacter phenolicus do produkcji benzoesanu, dostarczającego im energii niezbędnej do wzrostu; jest także głównym źródło węgla dla bakterii tlenowych Rhodococcus phenolicus. Fenol wykazuje działanie antyseptyczne (odkażające) w stosunku do wirusów, bakterii i grzybów, przyczyniając się do denaturacji ich białek komórkowych lub inaktywacji kluczowych enzymów. Fenol jest substancją toksyczną, wywołującą podrażnienia skóry, oczu i dróg oddechowych. Wysokie stężenie fenolu i jego oparów mogą powodować zawroty i bóle głowy, wymioty, duszności, zaburzenia orientacji bądź utratę przytomności.
Zastosowania fenolu
Fenol jest półproduktem wykorzystywanym w przemyśle chemicznym do produkcji żywic fenolowo-formaldehydowych ( fenoplasty), difenylopropanu ( żywice epoksydowe), cykloheksanolu ( włókna i tworzywa poliamidowe), chlorofenolu i pentachlorofenolu (PCP) ( środki chwastobójcze, grzybobójcze i dezynfekujące), krezoli ( tworzywa sztuczne, środki owadobójcze, materiały wybuchowe) oraz kwasu acetylosalicylowego ( aspiryna). Fenol ma również zastosowanie w produkcji barwników, farb i detergentów. Ze względu na właściwości antyseptyczne wykorzystywany jest w stomatologii do leczenia kanałowego miazgi zębowej. Fenol używany jest również w biologii molekularnej do oczyszczania kwasów nukleinowych (DNA, RNA) z zanieczyszczeń (np. białek, soli, detergentów) (ekstrakcja fenol-chloroform).
Bibliografia:
- Chemia organiczna – krótkie wykłady, Graham L. Patrick, Wydawnictwo Naukowe PWN, Warszawa 2018.
- Chemia organiczna, John McMurry, Wydawnictwo Naukowe PWN, Warszawa 2005.
- Chemistry³. Introducing inorganic, organic and physical chemistry, Andrew Burrows, John Holman, Andrew Parsons, Gwen Pilling, Gareth Price, Oxford University Press, 2017.
- Nowoczesne kompendium chemii, -H. Lautenschlager, W. Schroter, A. Wanninger, Wydawnictwo Naukowe PWN, Warszawa 2016.
- Organic Chemistry, Jonathan Clayden, Nick Greeves, Stuart Warren, Oxford University Press, 2012.
- Podstawy chemii dla kandydatów na wyższe uczelnie, K.M. Pazdro, Wydawnictwo Edukacyjne, Warszawa 1991.





