dioksyny
Dioksyny — polichlorowane dibenzo-p-dioksyny (PCDD) – organiczne związki chemiczne z grupy chlorowanych węglowodorów aromatycznych, stanowiące pochodne 1,4-dioksanu (C₄H₈O₂) bądź dibenzo-1,4-dioksanu (C₁₂H₈O₂). Cząsteczka dioksyn składa się z centralnie położonego pierścienia 1,4-dioksanu połączonego z dwoma pierścieniami benzenowymi, podstawionymi atomami chloru w określonych pozycjach (np. 2,3,7,8-tetrachlorodibenzo-p-dioksyna, TCDD). Dioksyny są bezbarwnymi (białymi) ciałami stałymi o strukturze krystalicznej; nie rozpuszczają się w wodzie. Są bardzo dobrze rozpuszczalne w tłuszczach i rozpuszczalnikach organicznych (np. benzenie, acetonie). Dioksyny stanowią trwałe zanieczyszczenia organiczne, ulegające akumulacji w łańcuchach pokarmowych. Są toksyczne dla zwierząt i człowieka; przyczyniają się do zaburzenia prawidłowej gospodarki hormonalnej organizmu, problemów z płodnością, osłabienia odporności, uszkodzenia wątroby, chorób układu krążenia i rozwoju nowotworów.
Występowanie dioksyn w przyrodzie
Dioksyny są organicznymi związkami chemicznymi występującymi powszechnie w środowisku przyrodniczym. Mogą one powstawać naturalnie w wyniku zdarzeń losowych, np. pożarów lasów i erupcji wulkanicznych, bądź jako produkty uboczne złożonych reakcji biochemicznych zachodzących podczas dekompozycji materii organicznej (np. w drodze syntezy ze związków chloroorganicznych). Obecność dioksyn w przyrodzie (powietrzu, glebach, osadach dennych zbiorników wodnych) jest jednak głównie bezpośrednim skutkiem działalności człowieka.
Antropogeniczne źródła dioksyn w środowisku obejmują:
- spalanie chlorowych związków organicznych obecnych w odpadach komunalnych, przemysłowych i medycznych oraz szlamach z oczyszczalni ścieków;
- wytapianie i rafinacja metali (miedzi, aluminium, cynku); obróbka metali; przetapianie złomu i surowców wtórnych; hutnictwo stali;
- produkcja tworzyw sztucznych (np. polichlorku winylu, PCV) oraz rozpuszczalników (np. chlorobenzenu, tetrachloroetylenu);
- wytwarzanie i stosowanie pestycydów (np. trichlorofenoli, pentachlorofenoli) oraz herbicydów fenoksylowych (chlorowych pochodnych kwasu fenoksyoctowego);
- wybielanie masy celulozowej przy użyciu chloru w produkcji papieru oraz środków higienicznych (np. chusteczek, wacików kosmetycznych, patyczków do uszu).
Dioksyny zaliczane są do trwałych zanieczyszczeń organicznych (TZO), co wynika w głównej mierze z bardzo powolnego rozkładu tych związków po uwolnieniu do środowiska, zdolności do bioakumulacji w łańcuchach pokarmowych i rozprzestrzeniania się na ogromne odległości od źródła emisji dzięki adsorpcji na cząsteczkach nieorganicznych i organicznych unoszących się w wodach bądź cząsteczkach sadzy, pyłów lub popiołów zawieszonych w powietrzu.
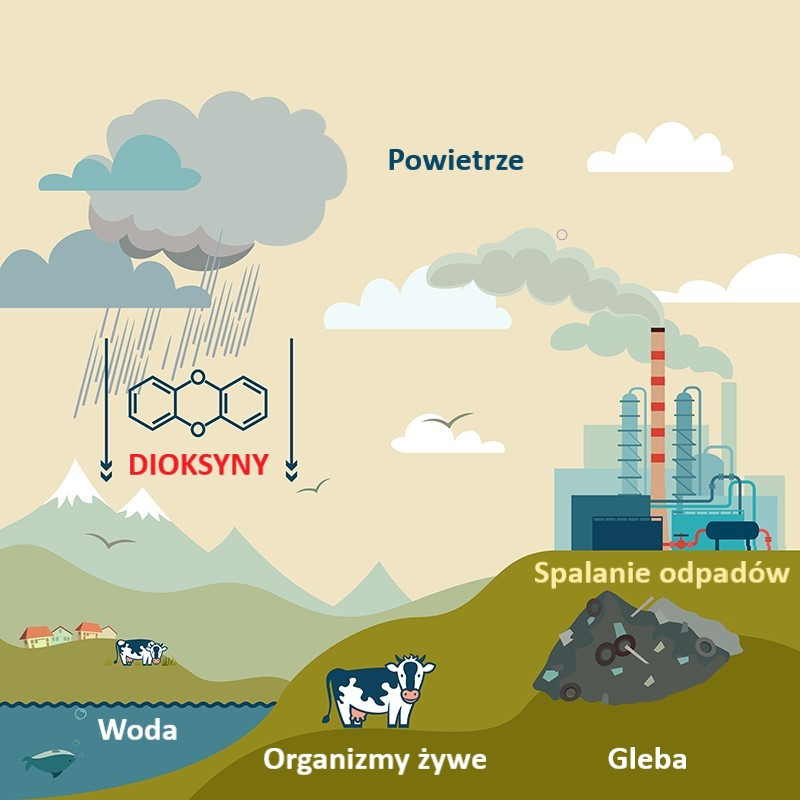
Dioksyny są trwałymi zanieczyszczeniami organicznymi obecnymi w powietrzu, glebach i wodach, ulegającymi akumulacji w tkankach organizmów żywych. Autor: Paul Lesser/shutterstock.com
Właściwości fizyczne dioksyn
Czyste dioksyny są bezbarwnymi lub białymi substancjami stałymi o strukturze krystalicznej (kryształy w kształcie igiełek). Pozbawione są wyraźnie wyczuwalnego zapachu. Dioksyny są związkami hydrofobowymi; są praktycznie nierozpuszczalne w wodzie. Ich rozpuszczalność maleje z liczbą atomów chloru w cząsteczce; dla dichlorodibenzo-p-dioksyny (DCDD) wynosi 1 µg/dm³ H₂O (25°C), dla tetrachlorodibenzo-p-dioksyny (TCDD) – 0,2 µg/dm³ H₂O (25°C), natomiast dla heksachlorodibenzo-p-dioksyny (HxCDD) – 0,04 µg/dm³ H₂O (25°C). Dioksyny są bardzo dobrze rozpuszczalne w tłuszczach i niektórych rozpuszczalnikach organicznych (np. benzenie, chlorobenzenie, dichlorobenzenie, chloroformie lub acetonie). Znacznie słabiej rozpuszczają się w alkoholach alifatycznych (np. metanolu lub n-oktanolu).
Dioksyny charakteryzują się niską prężnością par, są więc substancjami o niewielkiej lotności. Temperatura topnienia dioksyn zależy od ilości i położenia atomów chloru i wynosi od 88°C (monochlorodibenzo-p-dioksyny) do 332°C (oktochlorodibenzo-p dioksyny). Dioksyny są związkami o wysokiej stabilności i nie ulegają rozkładowi termicznemu w temperaturach niższych niż 800°C. Dioksyny, ze względu na duże powinowactwo do tłuszczy (lipofilowość), ulegają adsorpcji na powierzchni cząstek nieorganicznych i organicznych obecnych w glebie, zawieszonych w wodzie bądź unoszących w powietrzu. Właściwości te umożliwiają im także przenikanie przez błony komórkowe i akumulację w tkance tłuszczowej organizmów żywych.
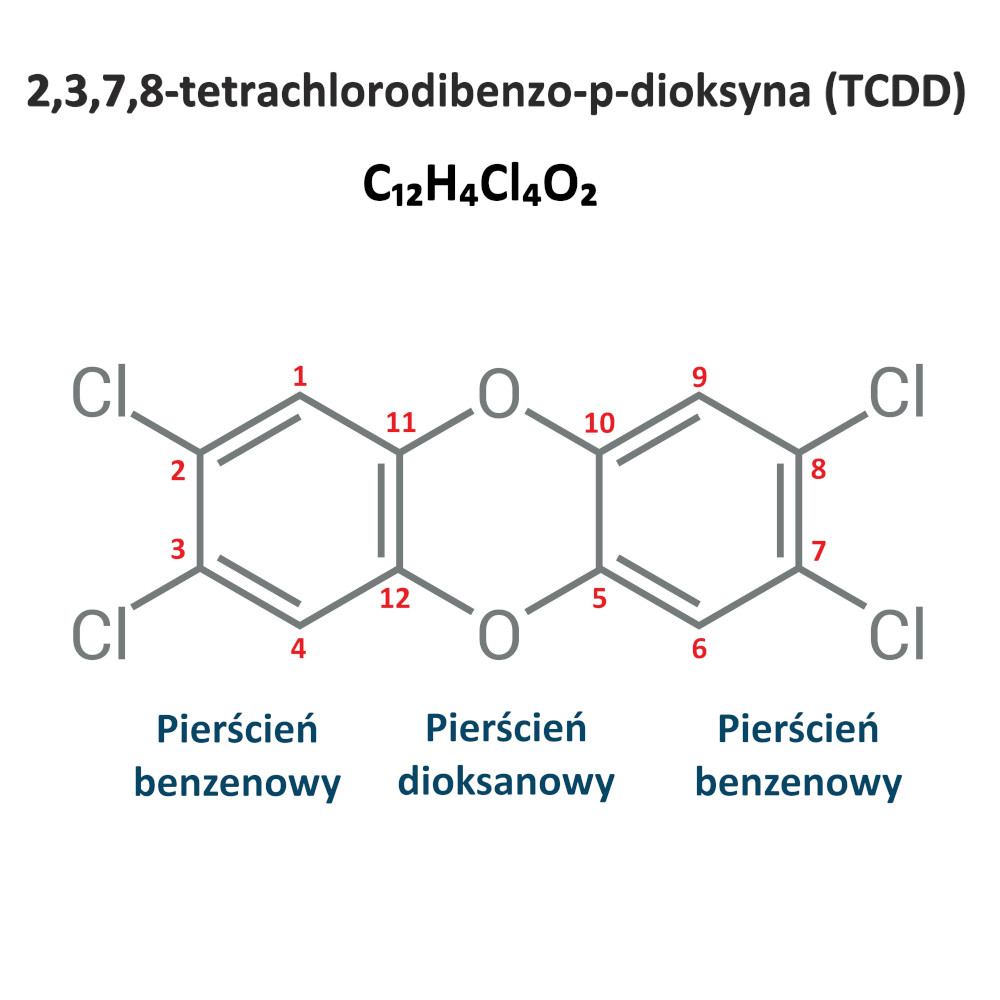
Budowa chemiczna cząsteczki 2,3,7,8-tetrachlorodibenzo-p-dioksyny (TCDD). Autor: zizou7/shutterstock.com
Budowa i właściwości chemiczne dioksyn
Dioksyny, polichlorowane dibenzo-p-dioksyny (PCDDs, ang. polychlorinated dibenzodioxins) są organicznymi związkami chemicznymi zaliczanymi do grupy chlorowanych węglowodorów aromatycznych. Stanowią one pochodne 1,4-dioksanu (C₄H₈O₂) bądź dibenzo-1,4-dioksanu (C₁₂H₈O₂). Cząsteczka składa się z centralnego pierścienia 1,4-dioksanu połączonego z dwoma pierścieniami benzenowymi, które podstawione są atomami chloru w określonych pozycjach. Najbardziej znanym przedstawicielem dioksyn jest 2,3,7,8-tetrachlorodibenzo-p-dioksyna (TCDD) o wzorze cząsteczkowym C₁₂H₄Cl₄O₂ i masie molowej wynoszącej 321,97 g/mol.
Polichlorowane dibenzo-p-dioksyny powstają głównie w procesach spalania chlorowych związków organicznych (w zakresie temperatur 250-400°C), w trakcie przemian termicznych chlorowanych fenoli i jako produkty uboczne syntez chemicznych (np. syntezy alifatycznych węglowodorów, chlorowania związków organicznych, otrzymywania tworzyw sztucznych, pestycydów i herbicydów). Dioksyny cechują się wysoką trwałością chemiczną; wykazują odporność na działanie środków utleniających, kwasów i zasad. Dioksyny utleniają się pod wpływem wysokiej temperatury (> 800°C) w obecności katalizatorów (np. chromu, tytanu).
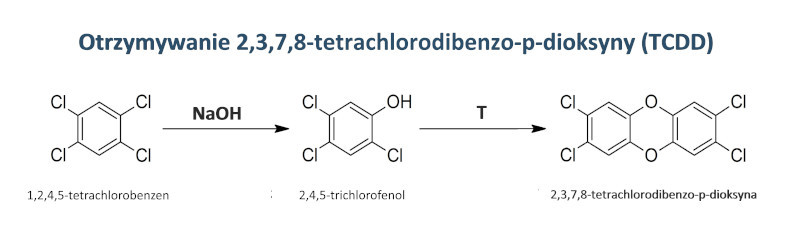
Polichlorowane benzo-p-dioksyny powstają w wyniku przemian termicznych chlorowanych fenoli. Autor: Roland Mattern/Wikimedia
Polichlorowane dibenzo-p-dioksyny (PCDDs) obejmują 75 związków o podobnej budowie chemicznej różniących się między sobą liczbą i położeniem atomów chloru (kongenerów), czyli różnych mono-, di-, tri-, tetra-, penta-, heksa-, hepta- i oktochlorodibenzo-p-dioksyn. Dioksyny, z polichlorowanymi dibenzofuranami (PCDFs, ang. polychlorinated dibenzofurans) (135 kongenerów) oraz polichlorowanymi difenylami (PCBs, ang. polychlorinated diphenyls) (209 kongenerów) stanowią związki dioksynopodobne (DLCs, ang. dioxin-like compounds).
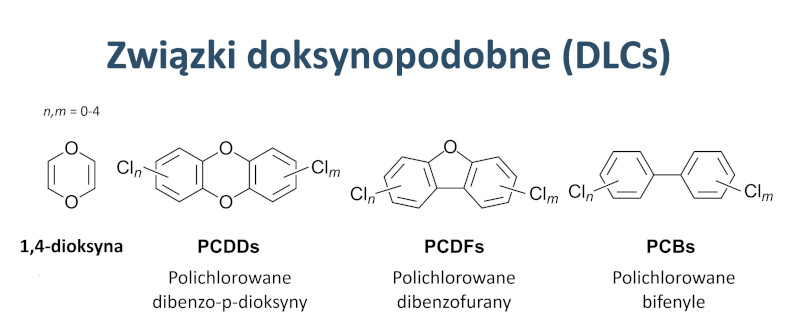
Związki dioksynopodobne (DLCs). Autor: Peter Hermes Furian/shutterstock.com
Znaczenie biologiczne dioksyn
Dioksyny są substancjami silnie toksycznymi dla organizmów żywych, wykazującymi działanie mutagenne (przyczyniające się do powstawania mutacji) i rakotwórcze (przyczyniające się do rozwoju nowotworów). Toksyczność tych związków wynika głównie ze zdolności do wiązania się z cytozolowym receptorem węglowodorów aromatycznych (AHR, ang. aryl hydrocarbon receptor). Powstałe kompleksy wpływają na zmianę ekspresji wielu genów, czego skutkiem są zaburzenia replikacji DNA, zakłócenie prawidłowego przebiegu procesów fizjologicznych w komórce bądź zahamowanie syntezy kwasów nukleinowych, węglowodanów lub lipidów. Najbardziej toksyczne właściwości wykazuje 2,3,7,8-tetrachlorodibenzo-p-dioksyna (TCDD).
Dioksyny obecne w środowisku dostają do organizmu człowieka głównie drogą pokarmową wraz z pożywieniem (ok. 90%); w znacznie mniejszym stopniu ich przenikanie do organizmu odbywa się przez drogi oddechowe (ok. 8%) lub przez skórę (ok. 2%) w wyniku wdychania lub kontaktu z cząstkami sadzy bądź pyłów z dioksynami zaadsorbowanymi na ich powierzchni.
Główne źródła dioksyn w diecie człowieka stanowią produkty bogate w tłuszcze zwierzęce:
- mięso (np. wołowina, wieprzowina, drób);
- przetwory mięsne (np. pasztety, konserwy, wędliny);
- mleko i produkty mleczne (np. twarogi, sery, jogurty);
- ryby i owoce morza (np. skorupiaki).
Dioksyny dostarczane do organizmu wraz z pokarmem ulegają akumulacji w wątrobie, tkance tłuszczowej, a także w skórze. Transport tych substancji do tkanek i narządów docelowych odbywa się dzięki ich wiązaniu się z lipidami i lipoproteinami osocza krwi.
Toksyczne oddziaływanie dioksyn polega głównie na uszkodzeniu struktury i zaburzeniu prawidłowego funkcjonowania narządów i układów narządów w organizmie:
- skóra – trądzik chlorowy (zaskórniki i torbiele spowodowane zaburzeniami funkcji gruczołów łojowych); hiperplazja (rozrost) i hiperkeratoza (nadmierne rogowacenie) komórek naskórka, brązowienie paznokci;
- wątroba – powiększenie wątroby (hepatomegalia) spowodowane hiperplazją (rozrostem) i hipertrofią (zwiększeniem masy) komórek wątroby (hepatocytów); choroby metaboliczne wątroby (porfirie wątrobowe);
- układ krwionośny – choroby układu krążenia (np. miażdżyca, nadciśnienie tętnicze, kardiomiopatia, przewlekłe stany zapalne tętnic); zawał mięśnia sercowego;
- układ odpornościowy – osłabienie odporności i wzrost podatności na infekcje; atrofia (zanik) obwodowych węzłów chłonnych, śledziony i grasicy; przewlekłe alergie;
- układ hormonalny – zaburzenie pracy hormonów tarczycy i hormonów rozrodczych; obniżenie płodności, problemy z zajściem i utrzymaniem ciąży; bezpłodność;
Dioksyny, ze względu na swe właściwości mutagenne i rakotwórcze, mogą przyczyniać się do powstawania i rozwoju łagodnych i złośliwych guzów w obrębie różnych narządów (np. płuc, wątroby, tarczycy), jak również zwiększać częstotliwość występowania nowotworów układu limfatycznego (chłoniaków) i tkanek miękkich (np. włókniakomięsaków, kostniakomięsaków).
Bibliografia:
- Chemia organiczna, John McMurry, Wydawnictwo Naukowe PWN, Warszawa 2005.
- Chemia środowiska, Gary W. VanLoon, Stephen J. Duffy, Wydawnictwo Naukowe PWN, Warszawa 2007.
- Chemistry of the Elements (2nd ed.), Norman Neill Greenwood, Alan Earnshaw, Butterworth-Heinemann, Oxford 1997.
- Chemistry³. Introducing inorganic, organic and physical chemistry, Andrew Burrows, John Holman, Andrew Parsons, Gwen Pilling, Gareth Price, Oxford University Press, 2017.
- Nowoczesne kompendium chemii, -H. Lautenschlager, W. Schroter, A. Wanninger, Wydawnictwo Naukowe PWN, Warszawa 2016.
- Podręczny słownik chemiczny, Romuald Hassa, Janusz Mrzigod, Janusz Nowakowski, Videograf II, Katowice 2004.






A jak powstaje?