neutron
Neutron, n – obojętna elektrycznie cząstka subjądrowa o masie spoczynkowej wynoszącej ok. 1,675 · 10⁻²⁷ kg, momencie magnetycznym o wartości -1,91 magnetonów jądrowych (µN) i niecałkowitym spinie ½, odkryta w 1932 r. przez angielskiego fizyka Jamesa Chadwicka. Neutron należy do podgrupy barionów w obrębie grupy hadronów; składa się z połączonych silnym oddziaływaniem kwarków – dwóch kwarków dolnych (d) i jednego kwarku górnego (u). Neutrony wraz z protonami są składnikami jąder atomowych; mogą również występować w postaci nietrwałych cząstek swobodnych. Wykorzystywane są w badaniach jader atomowych i sił jądrowych, badaniach struktury ciał stałych i cieczy, produkcji nuklidów promieniotwórczych oraz terapii chorób nowotworowych (terapia borowo-neutronowa).
Właściwości neutronu
Neutron (n) jest obojętną elektrycznie cząstką subjądrową o masie spoczynkowej wynoszącej ok. 1,675 · 10−27 kg, momencie magnetycznym o wartości -1,91 magnetonów jądrowych (µN), niecałkowitym spinie ½ (liczbie spinowej ½) oraz liczbie barionowej wynoszącej 1. Neutron został odkryty w 1932 r. przez angielskiego fizyka Jamesa Chadwicka; antycząstka neutronu (antyneutron) została odkryta w 1956 r. przez amerykańskiego fizyka Bruce’a Corka.
Neutron należy do grupy hadronów, złożonych cząstek subjądrowych uczestniczących w oddziaływaniach silnych, składających się z kwarków bądź gluonów. Neutron z protonem (nukleony) jako cząstki posiadające niecałkowity spin (fermiony) zaliczane są do podgrupy hadronów – barionów. Neutron jest cząstką złożoną z połączonych silnym oddziaływaniem kwarków – dwóch kwarków dolnych (d) i jednego kwarku górnego (u). Antyneutron (ń), różniący się od neutronu momentem magnetycznym (+1,91 µN) oraz liczbą barionową (-1), zbudowany jest z dwóch antykwarków antydolnych (d’) i jednego antykwarku antygórnego (ū).
Neutrony, jak wszystkie cząstki elementarne, wykazują dualizm korpuskularno-falowy – przejawiają zarówno cechy cząstek obdarzonych masą (właściwości korpuskularne) oraz cechy fali (fale materii, fale de Broglie’a) – mogą ulegać zjawiskom dyfrakcji i interferencji.
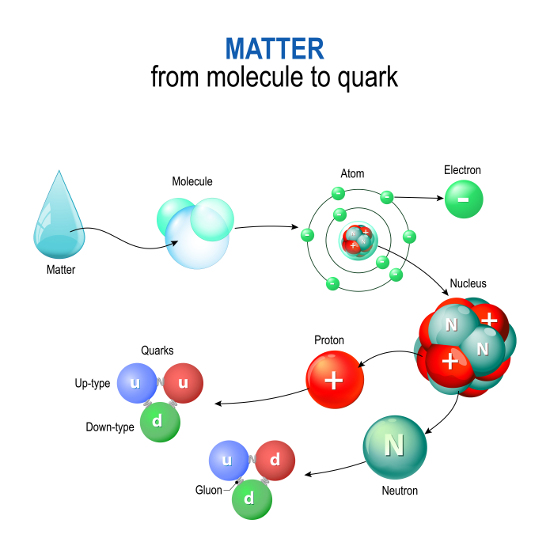
Neutron jako składnik atomu
Atom jest podstawowym składnikiem materii, składającym się z jądra atomowego o dużej gęstości (ok. 99,9% masy całego atomu) oraz krążących wokół jądra ujemnie naładowanych elektronów. Jądro atomowe składa się z określonej liczby trwałych, dodatnio naładowanych protonów (liczba atomowa, Z) oraz z określonej liczby obojętnych elektrycznie, przeważnie trwałych neutronów (liczba neutronowa, N). Suma nukleonów (protonów i neutronów) określana jest jako liczba masowa, A (A = Z + N). Atomy zawierające tę samą liczbę protonów (o tej samej liczbie atomowej) są atomami tego samego pierwiastkaizotopy danego pierwiastka chemicznego.
Protony i neutrony wiązane są w jądra atomowe za pomocą silnych oddziaływań, zwanych siłami jądrowymi. Są one na ogół siłami przyciągającymi, cechują się krótkim zasięgiem działania (ok. 1-2 fm) oraz niezależnością od ładunku elektrycznego nukleonów – siły działające pomiędzy protonami (p-p), neutronami (n-n) oraz protonami i neutronami (p-n) wykazują w przybliżeniu równe wartości. Protony i neutrony pod wpływem sił jądrowych zachowują się jak dwa stany kwantowe tej samej cząstki – tworzą tzw. dublet izospinowy (izospin).
Neutron swobodny
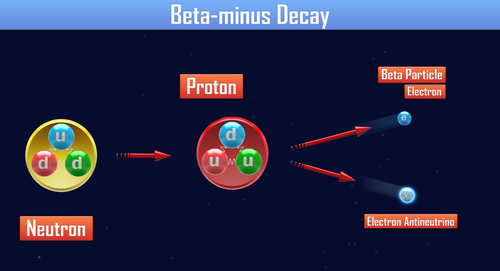
Neutrony swobodne (n0) występujące w postaci niezwiązanej z jądrem atomowym są cząstkami nietrwałymi o średnim czasie życia wynoszącym ok. 15 minut (881,5 ± 1,5 s). Ulegają one procesom rozpadu promieniotwórczego (rozpadu β⁻) przebiegających z wytworzeniem protonu (p+), elektronu (e–) oraz antyneutrina elektronowego (Ve)
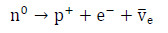
Neutrony swobodne, w zależności od średniej wartości energii kinetycznej (wyrażanej w elektronowoltach, eV), dzielą się na neutrony zimne (0,0–0,025 eV), neutrony termiczne (0,025 eV), neutrony epitermiczne (0,025–0,4 eV), neutrony kadmowe (0,4–0,5 eV), neutrony epikadmowe (0,5-1 eV), neutrony wolne (1-10 eV), neutrony rezonansowe (10-300 eV), neutrony pośrednie (300-1 MeV), neutrony szybkie (1-20 MeV) oraz neutrony superszybkie (>20 MeV).
Naturalnym źródłem promieniowania neutronowego składającego się z swobodnych neutronów są procesy spalacji (kruszenia jądra atomowego), polegające na bombardowaniu atomów atmosfery ziemskiej przez cząstki promieniowania kosmicznego (np. miony). Emisja neutronów swobodnych może być również spowodowana spontanicznymi procesami rozszczepienia jąder pierwiastków obecnych w minerałach skorupy ziemskiej (np. uranu, toru).
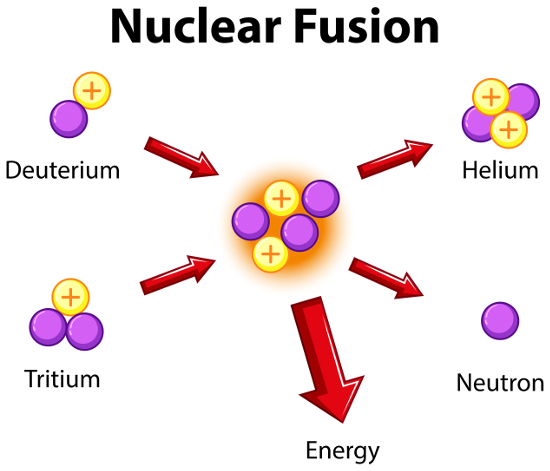
Neutrony swobodne na potrzeby badawcze uzyskiwane są na drodze reakcji rozszczepienia jądra atomowego (w reaktorach jądrowych), rozpadu promieniotwórczego izotopów niektórych pierwiastków (np. kalifornu ²⁵²Cf) oraz syntezy jądrowej (fuzji termojądrowej) polegającej na łączeniu dwóch lżejszych jąder atomowych w jedno jądro cięższe (np. fuzja jąder izotopów wodoru, deuteru i trytu, przeprowadzana w generatorze neutronów).
Wykorzystanie neutronów
Neutrony wykorzystywane są w badaniach jąder atomowych i sił jądrowych, w produkcji nuklidów promieniotwórczych oraz energii jądrowej. Cząstki te mają również zastosowanie w badaniach struktury ciał stałych i cieczy (np. dzięki wykorzystaniu zjawiska dyfrakcji neutronów termicznych na sieci krystalicznej analizowanej substancji) oraz w wykrywaniu i oznaczaniu pierwiastków chemicznych w badanym materiale (NAA – neutronowa analiza aktywacyjna).
Promieniowanie neutronowe wykorzystywane jest w terapii chorób nowotworowych (radioterapii). Stosuje się w tym celu neutrony superszybkie (terapia szybkimi neutronami, FNT) oraz neutrony epitermiczne (terapia borowo-neutronowa, BNCT).