izotopy
Izotopy, nuklidy izotopowe – rodzaje atomów należące do danego pierwiastka chemicznego, posiadające jednakową liczbę protonów (liczbę atomową) i różniące się między sobą liczbą neutronów i w konsekwencji liczbą nukleonów (liczbą masową), np. izotopy wodoru – prot (wodór-1) z jednym protonem w jądrze (¹H), deuter (wodór-2) z jednym protonem i jednym neutronem w jądrze (²H) i tryt (wodór-3) z jednym protonem i dwoma neutronami w jądrze (³H). Izotopy różnią się pomiędzy sobą właściwościami fizycznymi i chemicznymi (np. masą, gęstością, temperaturą wrzenia i topnienia, reaktywnością chemiczną), co przekłada się na właściwości związków chemicznych o różnym składzie izotopowym (tzw. efekt izotopowy). Przeważającą większość izotopów występujących naturalnie w przyrodzie stanowią izotopy trwałe (niepromieniotwórcze) wchodzące w skład pierwiastków czystych (posiadających tylko jeden rodzaj nuklidu) (np. fluoru, sodu, glinu, fosforu, kobaltu, jodu) bądź mieszanych (stanowiących mieszaninę dwóch bądź większej ilości nuklidów izotopowych) (np. wodoru, węgla, azotu, tlenu, magnezu, wapnia, cyny). Mniej powszechne są izotopy nietrwałe, które ulegają samorzutnemu rozpadowi (izotopy promieniotwórcze, radionuklidy) (np. węgiel-14, uran-238, rad-226). Radionuklidy naturalne (np. węgiel-14, potas-40) i radionuklidy sztuczne wytworzone metodami fizyki jądrowej (np. kobalt-60, molibden-99) wykorzystywane są w badaniach naukowych, medycynie, technice, energetyce i wielu gałęziach przemysłu.
Występowanie izotopów w przyrodzie
Izotopy (nuklidy izotopowe) są rodzajami atomów należącymi do określonego pierwiastka chemicznego, które posiadają jednakową liczbę protonów (tę samą liczbę atomową) i różnią się między sobą liczbą neutronów i w konsekwencji także liczbą nukleonów w jądrze (liczbą masową). Znaczną większość izotopów występujących naturalnie w przyrodzie stanowią izotopy trwałe (izotopy stabilne, niepromieniotwórcze) (ok. 250), które wchodzą w skład 80 pierwiastków o jednym (pierwiastków czystych) lub większej liczbie nuklidów ( pierwiastków mieszanych). Pierwiastki czyste zawierają tylko jeden rodzaj nuklidu (czyli jądra atomowego o jednakowej liczbie protonów i neutronów); do grupy tej należą 22 pierwiastki, m.in. beryl (⁹Be), fluor (¹⁹F), sód (²³Na), glin (²⁷Al), fosfor (³¹P), mangan (⁵⁵Mn), kobalt (⁵⁹Co), arsen (⁷⁵As), jod (¹²⁷I) i złoto (¹⁹⁷Au). Pierwiastki mieszane stanowią mieszaninę dwóch bądź większej ilości nuklidów izotopowych (czyli jąder atomowych o jednakowej liczbie protonów i różnej liczbie neutronów) cechującą się ściśle określonym i przeważnie stałym składem izotopowym; grupa ta obejmuje pozostałe pierwiastki chemiczne, m.in. wodór (¹H, ²H), węgiel (¹²C, ¹³C), azot (¹⁴N, ¹⁵N), chlor (³⁵Cl, ³⁷Cl), tlen (¹⁶O, ¹⁷O, ¹⁸O), magnez (²⁴Mg, ²⁵Mg, ²⁶Mg), wapń (⁴⁰Ca, ⁴²Ca, ⁴³Ca, ⁴⁴Ca, ⁴⁶Ca, ⁴⁸Ca) oraz cynę (¹¹²Sn, ¹¹⁴Sn, ¹¹⁵Sn, ¹¹⁶Sn, ¹¹⁷Sn, ¹¹⁸Sn, ¹¹⁹Sn, ¹²⁰Sn, ¹²²Sn, ¹²⁴Sn).
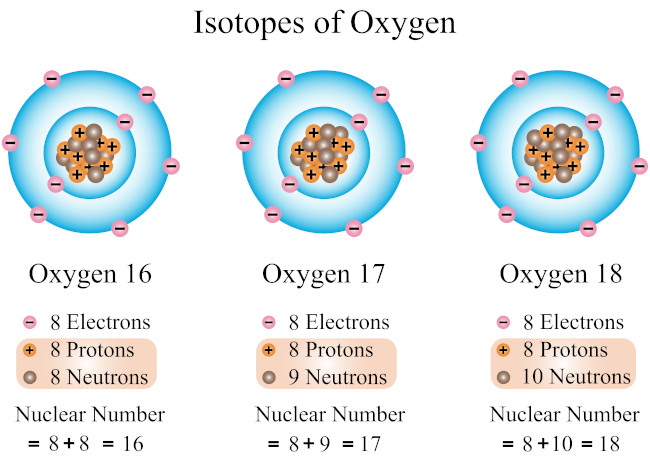
Znacznie mniej powszechne w przyrodzie są izotopy nietrwałe (niestabilne), które ulegają samorzutnemu rozpadowi (izotopy promieniotwórcze, radionuklidy). Na Ziemi występuje naturalnie ok. 86 radionuklidów. Są one produktem nukleosyntezy zachodzącej w gwiazdach przez powstaniem Układu Słonecznego (radionuklidy pierwotne, np. izotop toru ²³²Th, izotop uranu ²³⁸U); rozpadu radionuklidów pierwotnych, głównie toru-232 (²³²Th), uranu-238 (²³⁸U) oraz uranu-235 (²³⁵U) (radionuklidy radiogenne, np. izotop polonu ²¹⁶Po, izotop radu ²²⁶Ra); reakcji atomów z neutronami uwolnionymi w wyniku reakcji samorzutnego rozszczepienia jądra atomowego (radionuklidy nukleogenne, np. izotop plutonu, 239Pu) lub bezpośredniego zderzania się atomów pierwiastków z cząstkami promieniowania kosmicznego (radionuklidy kosmogenne, np. izotop węgla 14C). Oprócz naturalnie występujących w przyrodzie izotopów promieniotwórczych istnieje również ponad 3 tys. radionuklidów sztucznych wytworzonych metodami fizyki jądrowej. Należą do nich m.in. izotop fosforu (³²P), izotop kobaltu (⁶⁰Co), izotop molibdenu (⁹⁹Mo), metastabilny izotop technetu (99mTc), izotopy jodu (¹²³I, ¹²⁴I, ¹²⁵I, ¹³¹I) oraz izotopy transuranowców, czyli pierwiastków o liczbie atomowej większej niż liczba atomowa uranu (Z=92) – najcięższego pierwiastka naturalnego, np. izotop neptunu (²³⁷Np), izotopy plutonu (²³⁸Pu, ²³⁹Pu) i izotop ameryku (²⁴¹Am) i izotop kalifornu (²⁵²Cf).
Właściwości izotopów
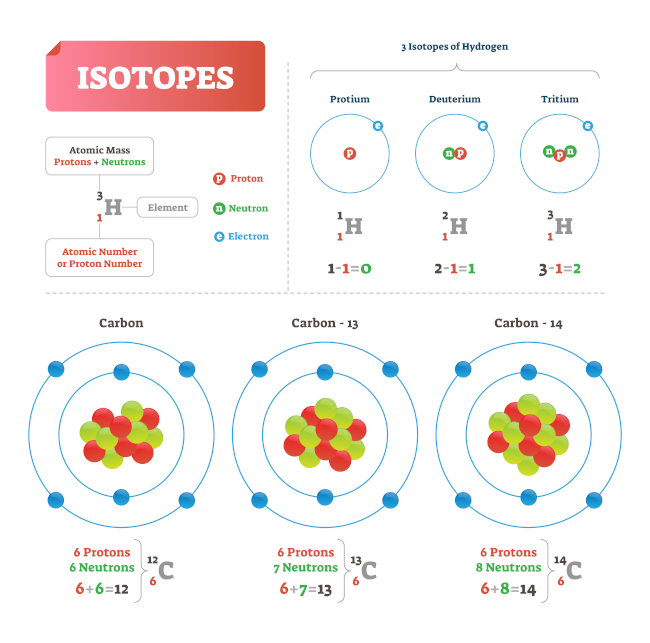
Izotopy (gr. ísos – równy, tópos – miejsce) są nuklidami, czyli rodzajami jąder zawierającymi równą liczbę protonów (jednakową liczbę atomową, Z) oraz różną liczbę neutronów, czego konsekwencją są różnice w łącznej liczbie nukleonów (protonów i neutronów) (opisywanej liczbą masową, A). Nuklidy posiadające taką samą liczbę atomową są nuklidami tego samego pierwiastka chemicznego (nuklidy izotopowe) i zajmują ściśle określone miejsce w układzie okresowym. Pierwiastkiem posiadającym kilka rodzajów nuklidów izotopowych jest wodór (występujący w przyrodzie jako mieszanina dwóch izotopów trwałych – wodoru-1, czyli protu (¹H) (1 proton) (99,985%) i wodoru-2, czyli deuteru (²H) (1 proton, 1 neutron) (0,015%) oraz śladowych ilości nietrwałego wodoru-3, czyli trytu (³H) (1 proton, 2 neutrony); i węgiel, który stanowi mieszaninę dwóch izotopów trwałych – węgla-12 (¹²C) (6 protonów, 6 neutronów) (98,89%) i węgla-13 (¹³C) (6 protonów, 7 neutronów) (1,11%) oraz śladowych ilości izotopu promieniotwórczego – węgla-14 (¹⁴C) (6 protonów, 8 neutronów).
Względna masa atomowa pierwiastków czystych (zawierających jeden rodzaj nuklidu) jest w przybliżeniu równa jego liczbie masowej, np. masa atomowa sodu (²³Na) wynosi 22,99 u (czyli ok. 23 u); masa atomowa kobaltu (⁵⁹Co) wynosi 58,93 u (czyli ok. 59 u). Względna masa atomowa pierwiastków mieszanych (stanowiących mieszaninę kilku nuklidów izotopowych) jest średnią ważoną mas atomowych wszystkich jego izotopów z uwzględnieniem ich udziału procentowego w mieszaninie:
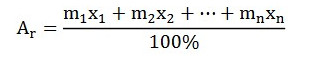
gdzie:
- Ar – względna masa atomowa pierwiastka [u],
- m – względna masa atomowa izotopów pierwiastka chemicznego [u],
- x – udział procentowy izotopów w mieszaninie [%].
Względna masa atomowa węgla (C) stanowi średnią ważoną mas atomowych trwałych izotopów tego pierwiastka – węgla-12 (¹²C) (98,89%) i węgla-13 (¹³C) (0,015%) z pominięciem śladowych ilości nietrwałego węgla-14 (¹⁴C):
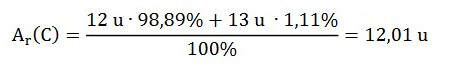
Względna masa atomowa chloru (Cl) stanowi średnią ważoną dwóch trwałych izotopów tego pierwiastka występujących w przyrodzie – chloru-35 (³⁵Cl) (75,8%) i chloru-37 (³⁷Cl) (24,2%):
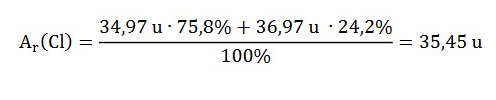

Izotopy tego samego pierwiastka chemicznego różnią się pomiędzy sobą właściwościami fizycznymi i chemicznymi (np. masą, gęstością, lepkością, temperaturą wrzenia i topnienia, przewodnością cieplną, reaktywnością wpływającą na szybkość reakcji chemicznych), czego skutkiem są zróżnicowane właściwości substancji i związków chemicznych o różnym składzie izotopowym (np. zmiana współczynnika załamania światła i współczynnika dyfuzji, zmiana temperatury wrzenia i topnienia, różnice w gęstości).
Zależność tą, określaną mianem efektu izotopowego, można zaobserwować w przypadku wodoru. Izotopy tego pierwiastka cechują się znacznymi różnicami masy atomowej, co wynika z różnej ilości neutronów w ich jądrach (masy atomowe deuteru ²H i trytu ³H są odpowiednio dwukrotnie i trzykrotnie większe od masy atomowej protu ¹H). Różnica masy atomowej protu i deuteru wpływa m.in. na różnice miedzy gęstością, temperaturą wrzenia i topnienia wody (H₂O) oraz wody ciężkiej (D₂O). Izotopy promieniotwórcze (radionuklidy). Izotopy promieniotwórcze, zwane także radionuklidami bądź radioizotopami, są nietrwałymi nuklidami ulegającymi samorzutnemu rozpadowi promieniotwórczemu, któremu towarzyszy emisja promieniowania jonizującego – strumienia cząstek α (czyli jąder atomów helu ⁴He) (promieniowanie α), ujemnie naładowanych elektronów (promieniowanie β⁻) lub dodatnich pozytonów (promieniowanie β⁺) i krótkofalowego promieniowania elektromagnetycznego w postaci strumienia fotonów (promieniowanie γ). Rozpad promieniotwórczy może prowadzić do zmiany liczby protonów w jądrze, czyli przekształcenia rozpadającego się atomu w atom innego pierwiastka, jak ma to miejsce podczas rozpadu alfa (przemiany α) uranu-238 (²³⁸U), toru-232 (²³²Th) bądź radu-226 (²²⁶Ra):

bądź rozpadu beta minus (przemiany β⁻) wodoru-3, czyli trytu (³H), węgla-14 (¹⁴C) bądź kobaltu-60 (⁶⁰Co):
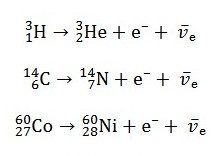
Reakcje rozpadu promieniotwórczego nietrwałych izotopów pierwiastków chemicznych mogą zachodzić z bardzo zmienną szybkością. Wielkość ta określana jest z wykorzystaniem tzw. okresu półtrwania (okresu połowicznego rozpadu) (T1/2), definiowanego jako okres czasu, w którym rozpada się połowa istniejących atomów danego pierwiastka chemicznego. Bardzo długi okres połowicznego rozpadu jest cechą charakterystyczną dla radionuklidów pierwotnych, np. toru-232 (²³²Th) (14 mld lat) i uranu-238 (²³⁸U) (4,5 mld lat); radionuklidów kosmogennych, np. chloru-36 (³⁶Cl) (30 tys. lat) i węgla-14 (¹⁴C) (5730 lat) oraz radionuklidów radiogennych, np. radu-226 (²²⁶Ra) (1602 lata). Znacznie szybciej rozpada się wodór-3 (tryt) (³H) (12,6 lat), kobalt-60 (⁶⁰Co) (5,27 lat) i cynk-65 (⁶⁵Zn) (245 dni). Najszybciej rozpadającymi się izotopami pierwiastków chemicznych są m.in. miedź-64 (⁶⁴Cu) (12,8 godzin), azot-13 (¹³N) (10 minut), węgiel-15 (¹⁵C) (2,5 sekundy) oraz tlen-15 (¹⁵O) (8,7 milisekund).
Zastosowania izotopów promieniotwórczych
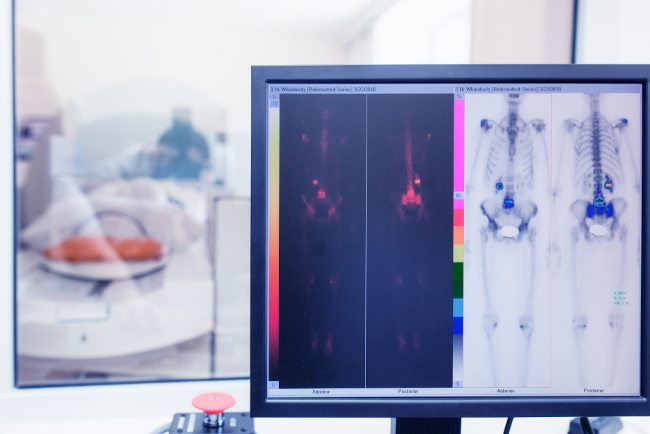
Izotopy promieniotwórcze pochodzenia naturalnego (radionuklidy naturalne) i wytworzone metodami fizyki jądrowej (radionuklidy sztuczne) wykorzystywane są w powszechnie w wielu dziedzinach nauki, medycynie, technice, energetyce i przemyśle. Radionuklidy, np. węgiel-14 (¹⁴C), stanowią znaczniki izotopowe w badaniach chemicznych (np. analizie radiochemicznej, badaniu mechanizmu reakcji chemicznych) i biologii (np. badaniu procesów metabolicznych, badaniu obiegu mikroelementów w przyrodzie, określaniu wpływu pestycydów i nawozów mineralnych na środowisko naturalne i organizmy żywe). Izotopy promieniotwórcze wielu pierwiastków, np. fosfor-32 (³²P), kobalt-60 (⁶⁰Co), molibden-99 (⁹⁹Mo), technet-99m (99mTc) i izotopy jodu (¹²³I, ¹²⁴I, ¹²⁵I, ¹³¹I) wykorzystywane są w medycynie do diagnozowania schorzeń narządów wewnętrznych (np. mózgu, serca, płuc, wątroby, nerek, tarczycy) i nowotworów mózgu, kości i stawów; badania krwiradioterapii). Radionuklidy mają także zastosowanie w wielu gałęziach przemysłu. Cez-137 (¹³⁷Cs) i iryd-192 (¹⁹²Ir) używane są do badania stanu technicznego i wykrywania wad materiałowych urządzeń przemysłowych (defektoskopia); kobalt-60 (⁶⁰Co) stosowany jest w procesie radiacyjnego utrwalania żywności; uran-235 (²³⁵U) stanowi źródło energii w elektrowniach jądrowychmetali ciężkich w wodzie. Węgiel-14 (¹⁴C) wykorzystywany jest w archeologii i paleontologii do określania wieku materiałów pochodzenia organicznego (tzw. datowanie radiowęglowe).