proton
Proton, p, p⁺ – trwała cząstka subjądrowa o dodatnim ładunku elektrycznym o wartości 1,602177 · 10⁻¹⁹ C, masie spoczynkowej ok. 1,673 · 10⁻²⁷ kg, momencie magnetycznym +2,79 magnetonów jądrowych (µN) i niecałkowitym spinie ½, odkryta w 1919 r. przez brytyjskiego fizyka Ernesta Rutherforda. Proton należy do podgrupy barionów w obrębie grupy hadronów; składa się z dwóch kwarków górnych (u) i jednego kwarku dolnego (d). Protony wraz z neutronami są składnikami jąder atomowych; mogą również występować w postaci cząstek swobodnych. Wykorzystywane są w badaniach jąder atomowych i sił jądrowych, produkcji izotopów promieniotwórczych, diagnostyce obrazowej (protonowa spektroskopia rezonansu magnetycznego) oraz terapii chorób nowotworowych (terapia protonowa).
Właściwości protonu
Proton (p, p⁺) jest trwałą, dodatnio naładowaną cząstką subjądrową o ładunku elektrycznym wartości 1,602177 · 10⁻¹⁹ C, masie spoczynkowej wynoszącej ok. 1,673 · 10⁻²⁷ kg, momencie magnetycznym o wartości +2,79 magnetonów jądrowych (µN), niecałkowitym spinie ½ (liczbie spinowej ½) oraz liczbie barionowej wynoszącej 1. Proton został odkryty w 1919 r. przez brytyjskiego fizyka Ernesta Rutherforda; antycząstka protonu (antyproton) została odkryta w 1955 r. przez amerykańskich fizyków Owena Chamberlaina i Emilio Segré.
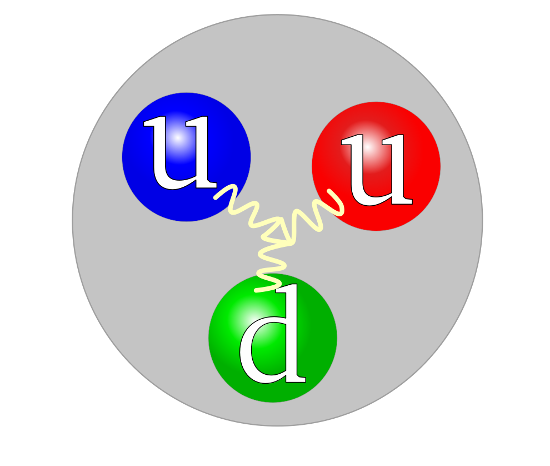
Proton należy do grupy hadronów, złożonych cząstek subjądrowych uczestniczących w oddziaływaniach silnych. Proton wraz z neutronem jako cząstki posiadające niecałkowity spin (fermiony) zaliczane są do podgrupy hadronów – barionów. Proton jest złożoną cząstką składającą się z połączonych silnym oddziaływaniem kwarków – dwóch kwarków górnych (u) i jednego kwarku dolnego (d). Antyproton (p), różniący się od protonu momentem magnetycznym (-2,79 µN) oraz liczbą barionową (-1), zbudowany jest z dwóch antykwarków antygórnych (u) i jednego antykwarku antydolnego (d).
Protony, jak wszystkie cząstki elementarne, wykazują dualizm korpuskularno-falowy – przejawiają zarówno cechy cząstek obdarzonych masą (właściwości korpuskularne) oraz cechy fali (fale materii, fale de Broglie’a) – mogą ulegać zjawiskom dyfrakcji i interferencji.
Proton jako składnik atomu
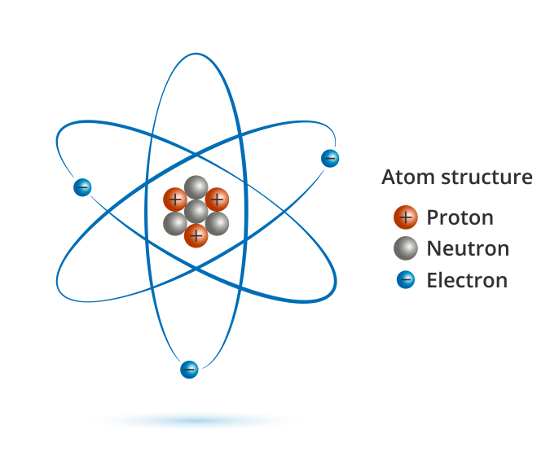
Atom jest podstawowym składnikiem materii, składającym się z jądra atomowego o dużej gęstości oraz krążących wokół jądra ujemnie naładowanych elektronów. Jądro atomowe każdego pierwiastka chemicznego (poza jądrem izotopu wodoru ¹H zawierającego wyłącznie jeden proton) składa się z określonej liczby dodatnio naładowanych cząstek – protonów (liczba atomowa, Z) oraz z określonej liczby cząstek obojętnych elektrycznie – neutronów (liczba neutronowa, N). Suma nukleonów (protonów i neutronów) określana jest jako liczba masowa, A (A = Z + N). Atomy zawierające tę samą liczbę protonów (o tej samej liczbie atomowej) są atomami tego samego pierwiastka; atomy różniące się liczbą neutronów (liczbą neutronową oraz liczbą masową) stanowią izotopy danego pierwiastka chemicznego.
Protony i neutrony wiązane są w jądra atomowe za pomocą silnych oddziaływań, zwanych siłami jądrowymi. Są one na ogół siłami przyciągającymi, cechują się krótkim zasięgiem działania (ok. 1-2 fm) oraz niezależnością od ładunku elektrycznego nukleonów – siły działające pomiędzy protonami (p-p), neutronami (n-n) oraz protonami i neutronami (p-n) wykazują w przybliżeniu równe wartości. Protony i neutrony pod wpływem sił jądrowych zachowują się jak dwa stany kwantowe tej samej cząstki – tworzą tzw. dublet izospinowy (izospin). Naładowane ujemnie elektrony krążące wokół jądra atomowego przyciągane są siłami elektrostatycznymi przez znajdujące się w jądrze dodatnio naładowane protony.
Proton swobodny
Protony swobodne (p⁺) niezwiązane z jądrem atomowym zgodnie z założeniami modelu standardowego jako najlżejsze cząstki z grupy barionów są cząstkami trwałymi, nie ulegającymi procesom samorzutnego rozpadu. Cząstki te mogą jednak ulegać przemianie pod wpływem dostarczenia odpowiedniej ilości energii. W reakcji jądrowej określanej mianem wychwytu elektronu (odwrotnej przemiany β) jeden z elektronów (e–) znajdujący się zwykle na powłoce elektronowej położonej najbliżej jądra atomowego przechwytywany jest przez proton (p+), wskutek czego dochodzi do powstania neutronu (n0) oraz emisji neutrina elektronowego (Ve):
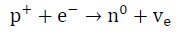
Proces ten jest odwracalny, nietrwałe neutrony po upływie ok. 15 minut ulegają procesowi spontanicznego rozpadu (rozpadu β⁻) z wytworzeniem protonu (p+), elektronu (e–) oraz antyneutrina elektronowego (Ve):
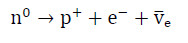
Protony swobodne występują naturalnie w plazmie (zjonizowanej materii o gazowym stanie skupienia zawierającej równoważne ilości ładunków dodatnich i ujemnych), gdzie wysokie temperatury uniemożliwiają oddziaływanie tych cząstek z elektronami (np. w jądrach gwiazd). Cząstki te stanowią główny składnik (ok. 90%) pierwotnego promieniowania kosmicznego. Protony swobodne są także produktami niektórych reakcji rozpadu promieniotwórczego oraz rozpadu bardzo nietrwałych cząstek złożonych (np. hiperonów oraz mezonów); mogą powstawać również w wyniku jonizacji termicznej atomów wodoru.
Wykorzystanie protonów
Protony wykorzystywane są w fizyce jądrowej w badaniach jąder atomowych i sił jądrowych oraz w procesach produkcji izotopów promieniotwórczych (np. radioizotopów medycznych). Spektroskopia protonowa, jedna z głównych technik magnetycznego rezonansu jądrowego (NMR), używana jest w identyfikacji i badaniach struktury białek i innych złożonych związków organicznych.
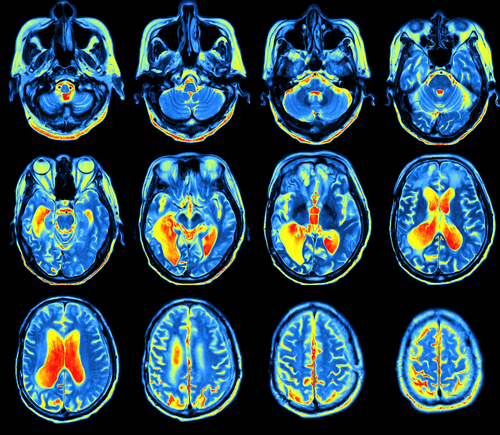
Protony mają również zastosowanie w diagnostyce obrazowej wykorzystywanej np. do wczesnego wykrywania zmian nowotworowych w ośrodkowym układzie nerwowym (spektroskopia magnetycznego rezonansu jądrowego, NMR) oraz w terapii chorób nowotworowych (radioterapia protonowa).