anion
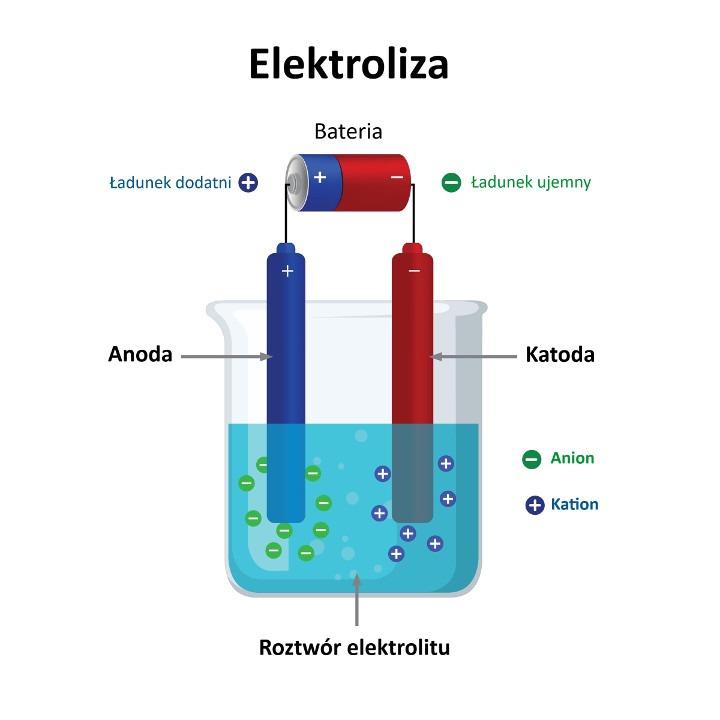
Anion, jon ujemny – pojedynczy atom lub cząsteczka (grupa atomów połączonych wiązaniami chemicznymi) obdarzone ujemnym ładunkiem elektrycznym, powstałe w wyniku przyjęcia elektronów przez określony atom lub cząsteczkę wyjściową. Aniony, jako jony cechujące się nadmiarem elektronów w stosunku do protonów, podczas elektrolizy migrują w kierunku przeciwnie naładowanej elektrody dodatniej (anody). Aniony powstają głównie w wyniku redukcji atomów pierwiastków niemetalicznych (np. chloru) lub rozpadu cząsteczek związków chemicznych (zasad, kwasów, soli) pod wpływem rozpuszczalnika (dysocjacji elektrolitycznej).
Zróżnicowane są na aniony proste zbudowane z atomów jednego pierwiastka chemicznego (np. chlorki, Cl––) oraz aniony złożone składające się z atomów kilku pierwiastków chemicznych (np. azotany, NO₃––). Aniony odpowiedzialne są za regulację gospodarki wodno-elektrolitowej organizmów żywych (osmoregulację) i żywienie mineralne roślin (pobieranie niezbędnych składników odżywczych z gleby). Mają zastosowanie w wielu dziedzinach nauki, medycynie i różnych gałęziach przemysłu (np. przemyśle chemicznym).
Powstawanie anionów
Aniony, czyli jony obdarzone ładunkiem ujemnym, powstają w wyniku jonizacji polegającej na przyłączaniu jednego lub większej liczby elektronów do elektrycznie obojętnych atomów pojedynczych lub złożonych cząsteczek związków chemicznych. Proces tworzenia anionów zależy w głównej mierze od zdolności atomów lub cząsteczek do przyjmowania elektronów (powinowactwa elektronowego). Tendencja do tworzenia anionów jest szczególnie silnie zaznaczona wśród atomów pierwiastków chemicznych z grupy 15 (azotowców), grupy 16 (tlenowców) i grupy 17 układu okresowego (fluorowców) przyjmujących elektrony w celu uzyskania pełnego oktetu elektronów walencyjnych (trwałej konfiguracji gazu szlachetnego).
Jonizacja, czyli powstawanie anionów (jonów ujemnych) z obojętnych atomów i cząsteczek, może zachodzić pod wpływem:
- wzajemnych zderzeń obojętnych elektrycznie atomów lub cząsteczek związków chemicznych pod wpływem wysokiej temperatury (tzw. jonizacja termiczna);
- wybicia elektronu z powłok atomowych w wyniku absorpcji kwantu promieniowania elektromagnetycznego (fotonu) o energii równej lub wyższej niż energia jonizacji atomów lub cząsteczek związków chemicznych (tzw. fotojonizacja);
- zderzenia atomów i cząsteczek związków chemicznych z cząstkami promieniowania cząsteczkowego o wysokiej energii (np. protonami, elektronami, cząstkami α);
- pola elektrycznego nadającego naładowanym cząstkom (np. elektronom, jonom) energię równą lub wyższą od energii jonizacji atomów lub cząsteczek związków chemicznych (tzw. jonizacja w polu elektrycznym);
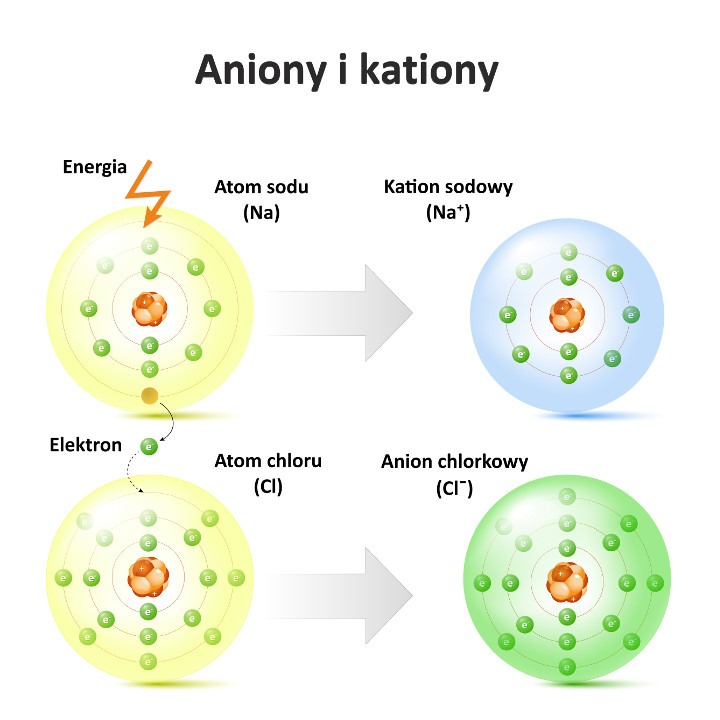
- przeniesienia elektronów między atomami lub cząsteczkami związków chemicznych (donorami i akceptorami), np. reakcja atomów sodu (Na) i chloru (Cl) z wytworzeniem kationu sodu (Na⁺) i anionu chlorkowego (Cl–) (tzw. jonizacja chemiczna);
- samorzutnego rozpadu ciekłych roztworów substancji jonowych (tzw. elektrolitów) (np. kwasów, zasad, soli) do kationów i anionów w wyniku oddziaływania cząsteczek rozpuszczalnika (np. wody) (tzw. dysocjacja elektrolityczna
- rozszczepienia silnie spolaryzowanych wiązań atomowych w wyniku oddziaływania rozpuszczalnika, np. dysocjacja elektrolityczna wody w roztworze wodnym do kationu hydroniowego (H₃O⁺) i anionu hydroksylowego (OH⁻) (tzw. autodysocjacja wody).
Aniony zbudowane z pojedynczych atomów (tzw. aniony proste) powstają głównie w wyniku przyjmowania elektronów na zewnętrzną powłokę elektronową (tzw. powłokę walencyjną). Proces ten zachodzi wskutek przenoszenia elektronów pomiędzy obojętnymi elektrycznie atomami metali (np. atomem sodu, Na) i atomami niemetali (np. atomem chloru, Cl). Aniony zbudowane z cząsteczek (tzw. aniony złożone) tworzą się w wyniku dysocjacji elektrolitycznej kwasów, zasad i soli pod wpływem oddziaływania cząsteczek rozpuszczalnika (np. wody).
Właściwości anionów
Anion (gr. anión – idący w górę) jest jonem obdarzonym ujemnym ładunkiem elektrycznym, występującym w postaci pojedynczego atomu bądź cząsteczki (grupy atomów połączonych wiązaniami chemicznymi), który tworzy się w wyniku przyjęcia jednego lub kilku elektronów przez odpowiedni atom lub cząsteczkę wyjściową. Anion, jako ujemnie naładowana cząstka, w trakcie elektrolizy (rozkładu substancji chemicznej pod wpływem przyłożonego napięcia elektrycznego) migruje w kierunku przeciwnie naładowanej elektrody dodatniej (anody). Aniony mogą występować w stanie wolnym (w fazie gazowej) lub tworzyć mniej lub silniej związane pary jonowe z przeciwnie naładowanymi jonami dodatnimi (czyli kationami).
Aniony, w zależności od budowy chemicznej swych cząstek, zróżnicowane są na:
- aniony proste (jednoatomowe) – aniony składające się wyłącznie z atomów jednego pierwiastka chemicznego, np. anion fluorkowy (F–), anion chlorkowy (Cl–), anion bromkowy (Br–), anion jodkowy (I–), anion azotkowy (N³–), anion tlenkowy (O²––), anion fosforkowy, anion siarczkowy (S²–
- aniony złożone (wieloatomowe, cząsteczkowe) – aniony składające się z atomów kilku pierwiastków chemicznych, np. anion węglanowy (CO₃²–), anion hydroksylowy (OH–), anion azotanowy (V) (NO₃–), anion siarczanowy (VI) (SO₄²⁻), anion fosforanowy (PO₄³–), anion cyjankowy (CN–), anion octanowy (CH₃COO–).
Aniony charakteryzują się ściśle określoną konfiguracją elektronową, czyli budową powłok elektronowych, oraz promieniem jonowym (promieniem van der Waalsa), czyli odległością elektronów położonych na zewnętrznej powłoce atomu (elektronów walencyjnych) od jądra atomu (aniony utworzone z pojedynczych atomów) bądź geometrycznego środka cząsteczki (aniony utworzone z kilku atomów). Jony ujemne posiadają nadmiar elektronów w stosunku do protonów, ich promienie jonowe są więc znacznie większe niż promienie jonowe atomów lub cząsteczek wyjściowych. Zależność ta spowodowana jest zwiększeniem siły odpychania elektrostatycznego pomiędzy elektronami oraz wzrostem rozmiarów chmury elektronowej.
Przykładowo:
- promień jonowy pojedynczego atomu chloru (Cl): r(Cl) = 99 pm, promień jonowy anionu chlorkowego (Cl–): r(Cl–) = 181 pm;
- promień jonowy pojedynczego atomu siarki (S): r(S) = 104 pm; promień jonowy anionu siarczkowego (S²–): r(S²–) = 184 pm
Anionami są wszystkie reszty kwasowe beztlenowych i tlenowych kwasów nieorganicznych (np. F–, Cl⁻, S²⁻, CN–, SO₃²–, SO₄²⁻, NO₂–, NO₃⁻, CO₃², PO₄³–, ClO₄⁻), reszty kwasowe kwasów organicznych (np. HCOO–, CH₃COO–) i jon hydroksylowy (wodorotlenkowy (OH–). Charakter ujemnie naładowanych jonów mają również jony obojnacze aminokwasów w roztworach zasadowych (np. jon obojnaczy glicyny: ⁺H₃N–CH₂–COO– + OH– → H₂N–CH₂–COO– + H₂O).

Wiązania jonowe
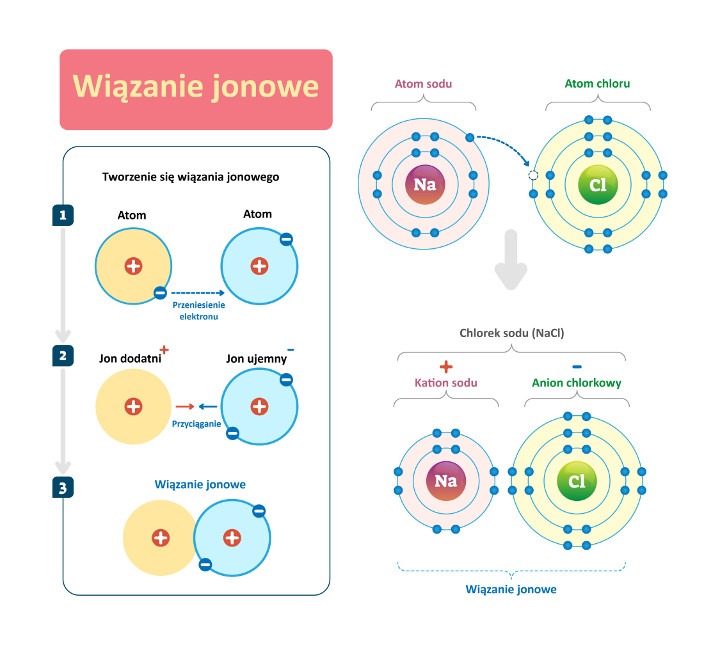
Aniony, jako jony obdarzone ładunkiem ujemnym, przyciągają jony naładowane dodatnio (kationy) za pośrednictwem sił oddziaływania elektrostatycznego (oddziaływania Coulomba) o nieskończonym zasięgu (rozchodzących się równomiernie we wszystkich kierunkach). Wzajemne interakcje jonów o ładunkach przeciwnych (tzw. jonów różnoimiennych) skutkują utworzeniem wiązań jonowych, mocno utrzymujących jony w węzłach sieci krystalicznej.
Wiązania jonowe (heteropolarne, elektrowalencyjne, biegunowe) tworzą się:
- między atomami pierwiastków o zróżnicowanej zdolności do przyciągania elektronów (tzw. elektroujemności), czyli atomami pierwiastków elektrododatnich skłonnych do oddawania elektronów (metali) i atomami pierwiastków elektroujemnych skłonnych do przyjmowania elektronów (niemetali
- w wyniku przejścia jednego lub większej ilości elektronów z atomu pierwiastka elektrododatniego (metalu) na atom pierwiastka elektroujemnego (niemetalu) pod wpływem stosunkowo niskiej energii jonizacji atomów metali i stosunkowo dużego powinowactwa elektronowego niemetali;
- pod wpływem oddziaływania sił przyciągania elektrostatycznego pomiędzy jonami dodatnimi (kationami) powstałymi w wyniku oddania elektronów przez atomy metali (utleniania) i jonami ujemnymi (anionami) powstałymi w wyniku przyjęcia elektronów przez atomy niemetali (redukcji).
Substancje jonowe (np. sole), powstające wskutek przyciągania elektrostatycznego pomiędzy przeciwnie naładowanymi kationami i anionami, są ciałami stałymi o krystalicznej strukturze przestrzennej (temp. 15-25°C), cechującymi się wysokimi temperaturami topnienia i wrzenia. Stopy i roztwory wodne substancji jonowych, dzięki obecności swobodnie poruszających się nośników ładunku (jonów), wykazują zdolność do przewodzenia prądu elektrycznego.
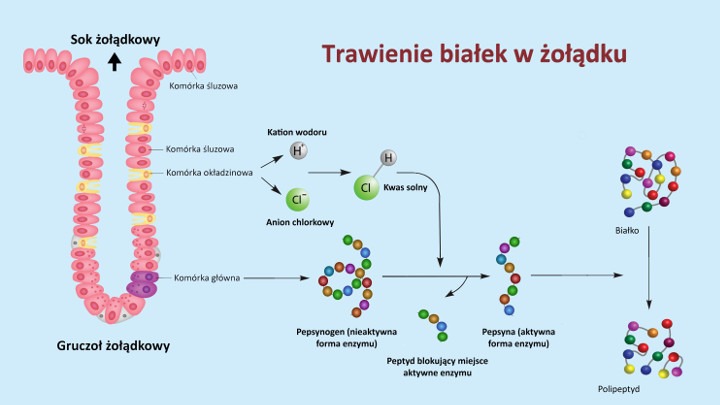
Znaczenie biologiczne anionów
Aniony są cząstkami spełniającymi szereg istotnych funkcji biologicznych niezbędnych dla prawidłowego funkcjonowania organizmów żywych (np. roślin i zwierząt). Aniony chlorkowe (Cl–) odpowiadają za regulację gospodarki wodno-elektrolitowej (tzw. osmoregulację) za pośrednictwem różnych mechanizmów utrzymujących równowagę wodną i odpowiednie stężenie substancji rozpuszczonej (ciśnienie osmotyczne płynów ustrojowych). Chlorki (Cl–) wraz z siarczanami (VI) (SO₄²–), wodorowęglanami (HCO₃–), fosforanami (PO₄³⁻), kationami wodoru (H⁺), sodu (Na⁺) i potasu (K⁺) biorą czynny udział w utrzymaniu równowagi kwasowo-zasadowej organizmu. Aniony chlorkowe (Cl–) wydzielane przez komórki okładzinowe błony śluzowej żołądka z kationami wodoru (H⁺) tworzą kwas solny (HCl) zapewniający kwaśne środowisko dla enzymów trawiących białka (pepsyny). Aniony wodorowęglanowe (HCO₃–) z kolei podnoszą pH soku żołądkowego po zakończeniu procesów trawiennych i neutralizują kwaśną treść pokarmową przechodzącą z żołądka do dwunastnicy. Aniony chlorkowe (Cl–), wodorowęglanowe (HCO₃–), siarczanowe (SO₄²–), azotanowe (NO₃–), diwodorofosforanowe (H₂PO₄–) i wodorofosforanowe (HPO₄²–) pełnią istotną rolę w odżywianiu mineralnym roślin umożliwiając im pobieranie niezbędnych składników odżywczych z roztworu glebowego.
Zastosowania anionów
Jony obdarzone ładunkiem ujemnym są powszechnie wykorzystywane w wielu dziedzinach nauki, medycynie, technice i różnych gałęziach przemysłu. Aniony stosowane są w analizie chemicznej do identyfikacji, ustalania struktury cząsteczki i składu chemicznego związków chemicznych bądź wyodrębniania ze złożonych mieszanin określonej substancji chemicznej (spektrometria masowa, chromatografia jonowymienna). W przemyśle chemicznym aniony wykorzystywane są głównie jako środki utleniające, np. chlorany (I), tzw. podchloryny (ClO–––) lub dichromiany (Cr₂O₇²––), wodorofosforany (HPO₄²–), diwodorofosforany (H₂PO₄–), używane są do produkcji nawozów mineralnych (sztucznych) wzbogacających glebę w składniki niezbędne dla prawidłowego wzrostu i rozwoju roślin (makroelementy). Aniony siarczanowe (IV), tzw. siarczyny (SO₃²–), wykorzystywane są w przemyśle spożywczym w charakterze konserwantów i wzmacniaczy smaku (np. w wyrobach winiarskich, suszonych owocach, przetworach owocowo-warzywnych). Aniony manganianowe (IV) (MnO₄–) i aniony chloranowe (I) (ClO–) są substancjami o działaniu antyseptycznym używanymi do dezynfekcji i uzdatniania wody. Aniony na skalę przemysłową mają również zastosowanie w produkcji czujników przeciwpożarowych, jonizatorów powietrza oraz wskaźników czystości wody.