jon
Jon – cząstka (atom lub cząsteczka) powstała z atomu lub cząsteczki wyjściowej w wyniku oddania lub przyjęcia elektronów, obdarzona ładunkiem dodatnim (kation) (wszystkie jony metali, np. Na⁺, Ca²⁺, Al³⁺; jon wodoru H⁺, jon oksoniowy (hydroniowy) H₃O⁺, jon amonowy NH₄⁺), ładunkiem ujemnym (anion) (jony reszt kwasowych, np. Cl⁻, ClO₄⁻, SO₄²⁻, NO₃⁻; jon wodorotlenowy OH⁻). Jony o przeciwnych ładunkach (jony różnoimienne) przyciągają się wzajemnie siłami oddziaływania elektrostatycznego, tworząc wiązania jonowe utrzymujące sieci przestrzenne kryształów jonowych (sieci jonowe). Powstałe związki jonowe (np. chlorek sodu, NaCl) charakteryzują się stosunkowo wysokimi temperaturami topnienia i wrzenia; po stopieniu lub rozpuszczeniu wykazują zdolność do przewodzenia prądu elektrycznego. Jony są niezbędne do prawidłowego funkcjonowania organizmów żywych; odpowiadają m.in. za równowagę wodno-elektrolitową (osmoregulację), transport tlenu i substancji odżywczych (np. cukrów, aminokwasów) do komórek, przewodzenie impulsów nerwowych oraz skurcze mięśni. Wykorzystywane są w wielu dziedzinach nauki, medycynie, technice oraz przemyśle.
Właściwości jonów
Jon (gr. ión – idący) jest cząstką, czyli pojedynczym atomem lub cząsteczką (grupą dwóch lub większej ilości atomów związanych wiązaniami chemicznymi), powstałą z określonego atomu lub cząsteczki wyjściowej w wyniku oddania lub przyjęcia elektronów. Jony zawierające tylko jeden atom określane są mianem jonów prostych (jednoatomowych) (np. jon sodu Na⁺, jon chloru Cl⁻), natomiast jony zawierające większą liczbę atomów zwane są jonami złożonymi (wieloatomowymi, cząsteczkowymi) (np. jon siarczanowy SO₄²⁻, jon amonowy NH₄⁺).
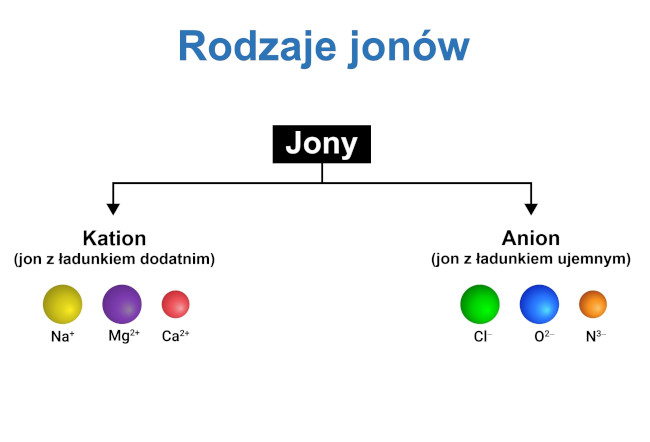
Jony, zależnie od ładunku elektrycznego (tzw. wartościowości jonowej), zróżnicowane są na:
- kationy (gr. katión – idący w dół) – jony obdarzone ładunkiem dodatnim, powstałe wskutek oddania elektronu przez atom lub cząsteczkę wyjściową; migrujące w stronę przeciwnie naładowanej elektrody ujemnej (katody) podczas elektrolizy
- aniony (gr. anión – idący w górę) – jony obdarzone ładunkiem ujemnym, powstałe w wyniku przyjęcia elektronu przez atom lub cząsteczkę wyjściową; migrujące w stronę przeciwnie naładowanej elektrody dodatniej (anody) podczas elektrolizy; do anionów zaliczane są wszystkie jony reszt kwasowych (Cl⁻, S²⁻, SO₄²⁻, NO₃⁻, CO₃², ClO₄⁻), jon wodorotlenkowy (hydroksylowy) (OH⁻);
- jony obojnacze (jony dwubiegunowe, amfijony) – jony posiadające zarówno ładunek dodatni, jak i ujemny; powstające z amfoterycznych związków chemicznych wskutek wewnątrzcząsteczkowej wędrówki protonu; w roztworach kwaśnych przechodzące w kationy, w roztworach zasadowych – w aniony; do jonów obojnacznych zaliczane są jony aminokwasów (np. jon obojnaczy glicyny ⁺H₃NCH₂COO⁻).
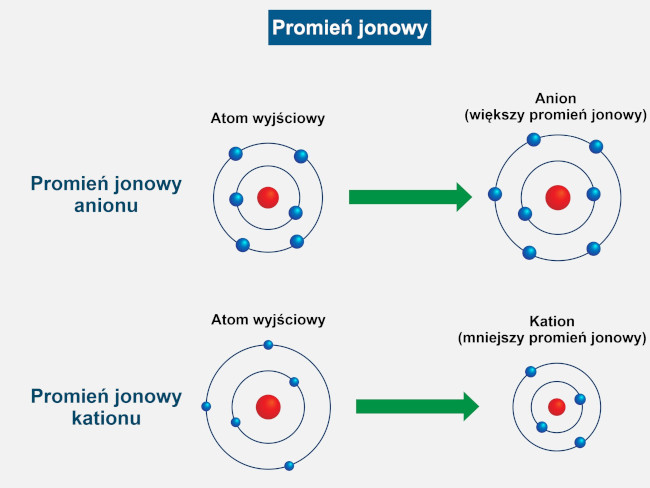
Jony cechują się także określoną konfiguracją elektronową (budową powłok elektronowych) oraz promieniem jonowym (odległością najbardziej oddalonych elektronów od jądra atomu lub geometrycznego środka cząsteczki). Kationy posiadają nadmiar protonów w stosunku do elektronów, zaś aniony – nadmiar elektronów w stosunku do protonów. Promienie jonowe jonów anionów są większe niż promienie jonowe atomów lub cząsteczek wyjściowych, co wynika ze zwiększenia siły oddziaływań elektrostatycznych (odpychania) między elektronami i wzrostem rozmiarów chmury elektronowej. Promienie jonowe kationów są z kolei znacznie mniejsze, co wynika ze zmniejszenia sił odpychania między elektronami oraz zbliżeniem się chmury elektronowej do jądra lub centrum geometrycznego cząsteczki.
Wiązania jonowe
Kationy i aniony, jako jony o ładunkach przeciwnych (tzw. jony różnoimienne), przyciągają się wzajemnie siłami oddziaływania elektrostatycznego (oddziaływania Coulomba) działającymi równomiernie we wszystkich kierunkach, tworząc wiązania jonowe (wiązania heteropolarne, polarne, elektrowalencyjne, biegunowe) mocno utrzymujących jony w węzłach regularnych sieci przestrzennych kryształów jonowych (tzw. sieci jonowych).
Wiązania jonowe powstają:
- między atomami pierwiastków chemicznych różniących się elektroujemnością, czyli zdolnością do przyciągania elektronów; np. atomami pierwiastków elektrododatnich (wykazujących tendencję do oddawania elektronów) (metali) i atomami pierwiastków elektroujemnych (wykazujących tendencję do przyjmowania elektronów) (niemetali
- w wyniku przeniesienia pojedynczego elektronu (lub większej liczby elektronów) z atomu pierwiastka elektrododatniego (metalu) na atom pierwiastka elektroujemnego (niemetalu), czemu sprzyja stosunkowo niska energia jonizacji atomów metali i duże powinowactwo elektronowe atomów niemetali;
- w wyniku przyciągania elektrostatycznego jonu obdarzonego ładunkiem dodatnim (kationu) powstałego w wyniku utlenienia obojętnego (nienaładowanego) atomu metalu oraz jonu obdarzonego ładunkiem ujemnym (anionu) powstałego w wyniku redukcji obojętnego (nienaładowanego) atomu niemetalu.
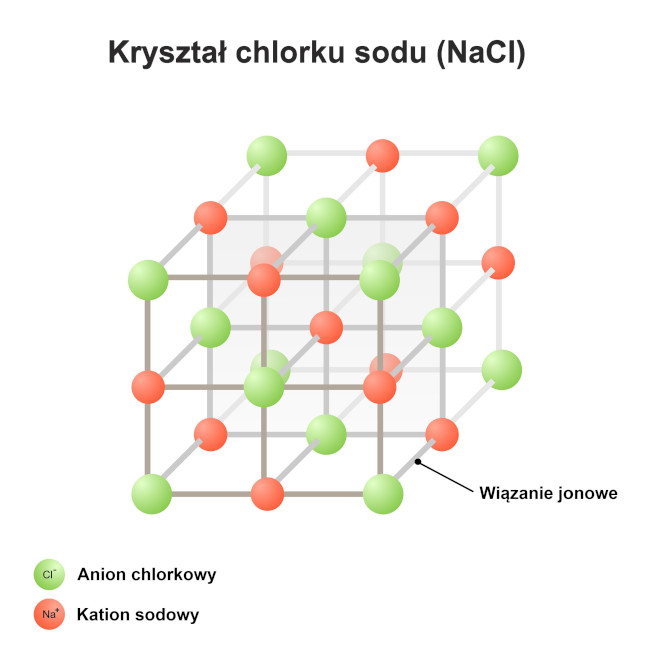
Reakcja pomiędzy atomem elektrododatniego pierwiastka metalicznego (np. atomu sodu, Na) i atomem elektroujemnego pierwiastka niemetalicznego (np. dwuatomowej cząsteczki chloru, Cl₂) prowadzi do powstania substancji jonowej (soli – chlorku sodu, NaCl):
Substancje jonowe w temperaturze pokojowej są ciałami stałymi o strukturze krystalicznej. Chlorek sodu (NaCl) cechuje się uporządkowaną siecią jonową w formie sześcianu z anionami chlorkowymi (Cl⁻) obsadzającymi węzły sieci i kationami sodowymi (Na⁺) wypełniającymi puste węzły sieciowe (tzw. luki). Wszystkie substancje jonowe wykazują stosunkowo wysokie temperatury topnienia i wrzenia, co wynika z silnych oddziaływań elektrostatycznych między przeciwnie naładowanymi jonami (kationami i anionami) (np. temperatura topnienia NaCl wynosi 801°C, temperatura wrzenia – 1413°C). Stopy i roztwory wodne substancji jonowych wykazują zdolność do przewodzenia prądu elektrycznego (przewodniki drugiej klasy) dzięki obecności swobodnie poruszających się nośników ładunków elektrycznych, czyli jonów.
Powstawanie jonów
Jony (kationy i aniony) powstają głównie w wyniku jonizacji, czyli zjawiska polegającego na oddawaniu bądź przyłączaniu pojedynczego elektronu (lub większej liczby elektronów) do elektrycznie obojętnych atomów lub cząsteczek związków chemicznych. Proces tworzenia kationów zachodzi przy określonej wartości energii jonizacji (minimalnej energii niezbędnej do odłączenia elektronu od atomu lub cząsteczki); powstawanie anionów zależy głównie od powinowactwa elektronowego (zdolności atomów lub cząsteczek do przyjęcia elektronów).
Zjawisko jonizacji może zachodzić pod wpływem:
- ruchów cieplnych i wzajemnych zderzeń obojętnych elektrycznie atomów lub cząsteczek związków chemicznych pod wpływem wysokiej temperatury (jonizacja termiczna, termojonizacja);
- oddziaływania promieniowania elektromagnetycznego o energii fotonów równej lub wyższej niż energia jonizacji (potencjał jonizacyjny) atomów lub cząsteczek związków chemicznych (fotojonizacja);
- zderzeń atomów lub cząsteczek związków chemicznych z cząstkami promieniowania korpuskularnego (cząsteczkowego) o wysokiej energii (np. protonami, elektronami, cząstkami α);
- pola elektrycznego przyspieszającego naładowane cząstki (np. elektrony, jony) do energii równej lub wyższej od energii jonizacji atomów lub cząsteczek związków chemicznych (jonizacja w polu elektrycznym);
- przenoszenia elektronów między atomami lub cząsteczkami związków chemicznych, np. reakcja atomu sodu (Na) z atomem chloru (Cl) prowadząca do powstania kationu sodowego (Na⁺) i anionu chlorkowego (Cl⁻);
- połączenia jonów z obojętnymi elektrycznie atomami lub cząsteczkami związków chemicznych, np. reakcja przyłączenia kationu wodoru (H⁺) do cząsteczki amoniaku (NH₃) prowadząca do powstania kationu amonowego (NH₄⁺);
- samorzutnego rozpadu ciekłych roztworów substancji jonowych, tzw. elektrolitów (np. kwasów, zasad, soli) w roztworze wodnym pod wpływem dipolowych cząsteczek wody, prowadzącego do powstania kationów i anionów (dysocjacja elektrolityczna
- rozszczepienia silnie spolaryzowanych wiązań atomowych pod wpływem dipolowych cząsteczek wody, np. reakcja autodysocjacji wody prowadząca do powstania kationu oksoniowego (hydroniowego) (H₃O⁺) i anionu wodorotlenkowego (OH⁻).
Proces odwrotny do jonizacji, zwany rekombinacją jonów, polega na zobojętnianiu dodatnio naładowanych jonów (kationów) poprzez łączenie ich z ujemnie naładowanymi elektronami swobodnymi, co prowadzi do powstania obojętnych elektrycznie atomów lub cząsteczek.

Znaczenie biologiczne jonów
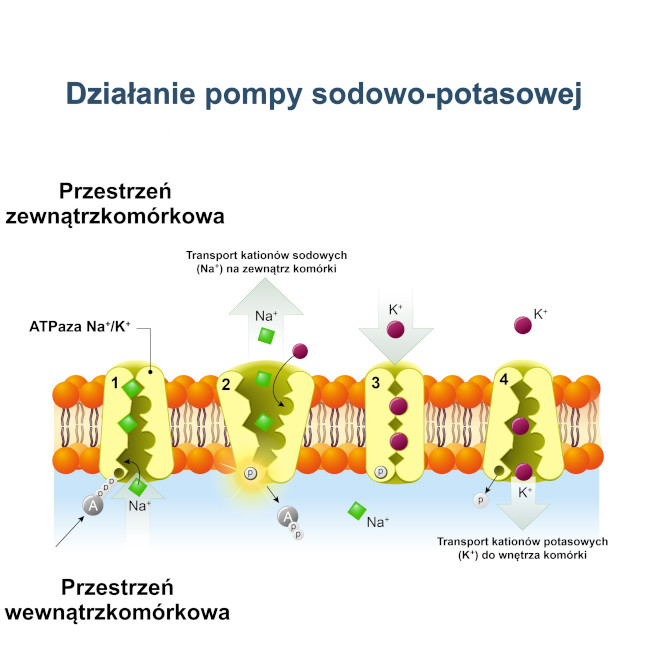
Jony są niezbędne do prawidłowego funkcjonowania organizmów żywych (roślin i zwierząt). Jony, np. kationy sodu (Na⁺), kationy potasu (K⁺) i aniony chlorkowe (Cl⁻) odpowiadają za gospodarkę wodno-elektrolitową dzięki mechanizmom osmoregulacyjnym polegającym na utrzymywaniu względnej równowagi wodnej i regulacji stężenia substancji rozpuszczonych, czyli ciśnienia osmotycznego płynów ustrojowych. Kationy wodoru (H⁺), sodu (Na⁺) i potasu (K⁺) z anionami chlorkowymi (Cl⁻), fosforanowymi (PO₄³⁻) i siarczanowymi (SO₄²⁻) uczestniczą w utrzymywaniu równowagi kwasowo-zasadowej. Jony stanowią podstawę funkcjonowania pomp jonowych – pompy sodowo-potasowej (ATPazy Na⁺/K⁺) uczestniczącej w pobudzaniu komórek nerwowych (przewodzenie impulsów nerwowych) i komórek mięśniowych (skurcze mięśni), regulacji transportu cukrów i aminokwasów do wnętrza komórki i kontroli objętości komórki zwierzęcej; pompy wapniowej (Ca²⁺-ATPazy) biorącej udział w regulacji skurczów mięśni i pompy protonowej (H⁺-ATPazy) umożliwiającej roślinom pobieranie substancji odżywczych przez włośniki korzeniowe i ruchy komórek szparkowych podczas transpiracji. Kationy żelaza są istotnymi składnikami przenośników tlenowych (hemoglobiny i mioglobiny) i cytochromów uczestniczących w łańcuchu transportu elektronów (łańcuchu oddechowym).
Wykorzystanie jonów
Jony stosowane są powszechnie w wielu dziedzinach nauki, medycynie, technice i różnych gałęziach przemysłu. Wykorzystywane są w analizie chemicznej do identyfikacji związków chemicznych i ich mieszanin, ustalania struktury, składu pierwiastkowego i izotopowego badanych związków chemicznych (spektrometria mas); w fizyce jądrowej jony używane są do przeprowadzania reakcji jądrowych, badania przebiegu tych reakcji i właściwości cząstek elementarnych i przebiegu reakcji. Przemysłowe i techniczne zastosowania jonów obejmują produkcję półprzewodników, zminiaturyzowanych urządzeń i obwodów elektronicznych, czujników przeciwpożarowych, jonizatorów (oczyszczaczy) powietrza, wskaźników jakości wody i środków biobójczych (biocydów) (np. pestycydów, zapraw nasiennych).
Ciekłe substancje jonowe (ciecze jonowe) używane są w przemyśle chemicznym (środowisko licznych reakcji chemicznych, np. reakcji Friedela-Craftsa), w elektrochemii (np. elektrolity, panele słoneczne, akumulatory litowo-jonowe, kondensatory elektrochemiczne), jako smary, rozpuszczalniki, plastyfikatory i środki dyspergujące. Stopy i roztwory substancji jonowych używane są do otrzymywania metali (np. glinu, litu, sodu, potasu) i związków chemicznych (np. wodorotlenku sodu, chloranu potasu, kwasu trifluorooctowego) w procesie elektrolizy. Wiązki ciężkich jonów (np. jony wodoru, jony węgla, jony tlenu) stosowane są w radioterapii (np. terapii hadronowej) do precyzyjnego niszczenia komórek nowotworowych.