chemiczne zapotrzebowanie tlenu (ChHZT)
Chemiczne zapotrzebowanie tlenu (ChHZT) — wskaźnik ilości tlenu pobranego z silnego utleniacza na utlenienie zawartych w wodzie związków organicznych i niektórych związków nieorganicznych; używany do oznaczania ilości zanieczyszczeń obecnych w wodach powierzchniowych i ściekach.
Oznaczanie chemicznego zapotrzebowania tlenu (ChZT)
Ogólna zasada oznaczania ChZT polega na wprowadzeniu do badanej próbki określonej ilości utleniacza oraz niezbędnych katalizatorów i substancji pomocniczych. Reakcja utleniania prowadzona jest w ściśle określonych warunkach – stopień utlenienia związków organicznych zależy m.in. od rodzaju użytego utleniacza, temperatury i czasu reakcji. Po zakończeniu procesu utleniania pozostała ilość utleniacza oznaczana jest w wyniku miareczkowania lub metodą spektrofotometryczną. Ubytek utleniacza, czyli ilość utleniacza zużyta na utlenienie związków w badanej próbce, przeliczona na ilość tlenu wyrażana jest w mg/dm³.
Oznaczanie ChZT można przeprowadzić różnymi metodami w zależności od użytego utleniacza. Przez wiele lat głównym związkiem utleniającym stosowanym w oznaczaniu ChZT był nadmanganian potasu (KMnO₄). Skuteczność tego związku jest jednak bardzo różna w zależności od rodzaju utlenianego związku organicznego. Nadmanganian potasu nie jest także w stanie utlenić wszystkich związków organicznych obecnych w badanej próbce wody. W metodzie tej zaczęto więc wykorzystywać inne związki utleniające, takie jak siarczan ceru Cs(SO₄)₂, jodan potasu (KIO₃) oraz dichromian potasu (K₂Cr₂O₇), spośród których najskuteczniejszym utleniaczem okazał się ostatni związek. Dichromian potasu jest w stanie utlenić prawie wszystkie związki organiczne obecne w wodzie, a ponadto jest stosunkowo tani i łatwy do oczyszczania.

Oznaczanie ChZT z wykorzystaniem nadmanganianu potasu (KMnO₄)
Oznaczanie ChZT z wykorzystaniem nadmanganianu potasu określa się również mianem metody nadmanganianowej lub utlenialności. Metoda ta zwykle wykorzystywana jest do analizy wód powierzchniowych (np. jezior i rzek). Nadmanganian potasu jest w stanie utlenić średnio ok. 60% związków organicznych obecnych w próbce, więc metoda ta daje tylko przybliżone pojęcie o składzie chemicznym badanej wody.
Zasada oznaczania utlenialności polega na utlenianiu związków organicznych i niektórych związków nieorganicznych (łatwo utleniających się) z wykorzystaniem nadmanganianu potasu w temperaturze wrzenia wody:
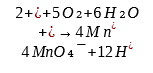
Następnie do roztworu dodaje się w nadmiarze kwas szczawiowy (C₂H₂O₄):
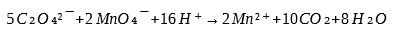
Nadmiar roztwór kwasu szczawiowego odmiareczkowuje się roztworem nadmanganianu potasu aż do uzyskania barwy jasnoróżowej.
Obecne w badanej wodzie jony chlorkowe Cl¯ w środowisku kwaśnym mogą wchodzić w reakcję w nadmanganianem potasu:
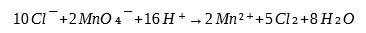
w związku z czym metoda ta wykorzystywana jest dla wód naturalnych o niskiej zawartości jonów chlorkowych (niższej niż 300mg/dm³).
Najniższa wartość utlenialności charakteryzuje wody artezyjskie (2mg/dm³) oraz czyste wody powierzchniowe (4mg/dm³). Utlenialność wód bagiennych wynosi ok. 400 mg/dm³.

Oznaczanie ChZT z wykorzystaniem dichromianu potasu (K₂Cr₂O₇)
Oznaczanie chemicznego zapotrzebowania tlenu z wykorzystaniem dichromianu potasu określana jest również mianem metody dichromianowej. Metoda ta stosowana jest przede wszystkim w analizie ścieków. Stopień utlenienia związków organicznych obecnych w badanej próbce wody wynosi 95-100%.
Zasada oznaczania ChZT polega na utlenianiu związków organicznych i niektórych związków nieorganicznych z wykorzystaniem dichromianu potasu w warunkach kwaśnych (dodatek kwasu siarkowego H₂SO₄) w temperaturze wrzenia wody:
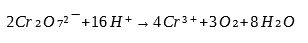
Nadmiar dichromianu potasu miareczkuje się siarczanem żelazowo-amonowym (solą Mohra) (NH₄)₂Fe(SO₄)₂ w obecności ferroiny (kompleksu 1,10-fenantroliny z Fe²⁺):
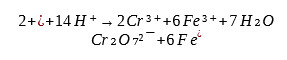
Barwa ferroiny podczas miareczkowania zmienia barwę z niebiesko-zielonej na czerwonobrązową. Dodana ilość siarczanu żelazowo-amonowego równoważna jest nadmiarowej ilości dichromianu potasu.
Wartość ChZT dla dobrze oczyszczonych ścieków komunalnych wynosi ok. 75 mg/dm³.

Utlenianie związków organicznych podczas oznaczania ChZT metodą dichromianową
Związki organiczne, takie jak cukry, związki alifatyczne z bocznymi łańcuchami i związki aromatyczne często ulegają całkowitemu utlenieniu pod wpływem dichromianu potasu. W reakcjach utleniania związków alifatycznych o prostych łańcuchach jako katalizatora używa się siarczanu (VI) srebra (stopień utleniania sięga wówczas 95-98%).
Związkami chemicznymi praktycznie nie ulegającymi utlenianiu w warunkach metody dichromianowej są benzen i jego homologi, pirydyna, związki heterocykliczne zawierające azot, mocznik i parafiny, związki trudno rozpuszczalne w wodzie, a także amoniak i związki azotowe powstające w wyniku rozkładu białek.
Związki zakłócające pomiar ChZT
Niektóre próbki analizowanej wody zawierają duże ilości utlenialnych związków nieorganicznych, z których jony chlorkowe stanowią najczęstsze źródło zakłóceń oznaczania chemicznego zapotrzebowania tlenu:
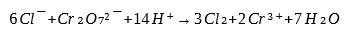
Jony chlorkowe, ulegając utlenianiu do wolnego chloru, zawyżają wartość oznaczenia ChZT, dlatego też często do próbki dodaje się siarczanu (VI) rtęci (II) (HgSO₄), który tworzy z jonami chlorkowymi rozpuszczalny związek kompleksowy.
Zawyżona wartość oznaczenia ChZT występuje także w przypadku obecności w badanej próbce jonów żelaza (II), jonów siarczanowych (IV) i azotanowych (III). Związkiem eliminującym zakłócenia ChZT wywołane obecnością jonów azotanowych (III) jest kwas sulfaminowy (H₂NSO₃H).







super :)