kwas solny
Kwas solny, kwas chlorowodorowy (HCl, HCl(aq)) – nieorganiczny związek chemiczny z grupy kwasów beztlenowych, stanowiący wodny roztwór gazowego chlorowodoru. Kwas solny jest przezroczystą bezbarwną bądź lekko żółtawą cieczą posiadającą ostry, duszący zapach. Jest substancją dymiącą na powietrzu – stale wydziela pewne ilości gazowego chlorowodoru (w ilości proporcjonalnej do stężenia), który w wyniku reakcji z wilgotnym powietrzem tworzy gęste, białe, żrące opary. Kwas solny jest jednym z najsilniejszych kwasów nieorganicznych; cechuje się bardzo dużą aktywnością chemiczną. Rozpuszcza większość metali (z wyj. metali szlachetnych), wydzielając gazowy wodór (H₂) oraz tworząc odpowiednie chlorki (np. chlorek glinu, AlCl₃). Otrzymywany jest na drodze absorpcji chlorowodoru w wodzie, bezpośredniej syntezy (spalania wodoru w chlorze), reakcji chlorku sodu ze stężonym kwasem siarkowym (VI) lub chlorowania związków organicznych (np. benzenu). Kwas solny obecny w kwaśnych opadach jest produktem zakwaszania wody atmosferycznej przez chlorowodór emitowany do atmosfery w wyniku spalania paliw, procesów produkcji przemysłowej bądź wybuchów wulkanów. Produkowany przez komórki okładzinowe żołądka ssaków (w tym człowieka) stanowi istotny składnik soku żołądkowego, który odpowiada za procesy trawienia białek. Kwas solny wykorzystywany jest powszechnie w przemyśle chemicznym, farmaceutycznym, włókienniczym i spożywczym, przemyśle tworzyw sztucznych, garbarstwie oraz metalurgii.
Występowanie kwasu solnego w przyrodzie
Kwas chlorowodorowy (HCl, HCl(aq)), zwany potocznie kwasem solnym, jest nieorganicznym związkiem chemicznym stanowiącym wodny roztwór gazowego chlorowodoru (HCl(g)). Kwas solny występuje w przyrodzie jako składnik kwaśnych opadów atmosferycznych (np. deszczu, mżawki) bądź innych produktów kondensacji pary wodnej w atmosferze (np. kwaśnej mgły) powstających w wyniku przemian fizycznych i reakcji chemicznych zachodzących pomiędzy składnikami atmosfery i emitowanymi do niej zanieczyszczeniami (pochodzenia naturalnego oraz antropogenicznego). Kwas solny obecny w kwaśnych opadach stanowi więc przykład zanieczyszczenia wtórnego, będącego produktem zakwaszania wody atmosferycznej przez chlorowodór emitowany do atmosfery w wyniku spalania paliw, unieszkodliwiania odpadów niebezpiecznych (np. tworzyw sztucznych), procesów produkcji przemysłowej lub wybuchów wulkanów (wraz z gazami wulkanicznymi). Kwas solny pełni także istotną rolę w przewodzie pokarmowym większości ssaków (w tym człowieka). Związek ten, wydzielany przez komórki okładzinowe żołądka, stanowi ważny składnik soku żołądkowego, który odpowiedzialny jest za aktywację enzymów trawiennych (pepsyny) uczestniczących w procesie trawieniu białek.

Właściwości fizyczne kwasu solnego
Kwas solny (HCl) jest bezbarwną bądź lekko żółtawą cieczą posiadającą charakterystyczny, ostry i duszący zapach. Żółtawe zabarwienie, charakterystyczne dla technicznego kwasu solnego, spowodowane jest śladową domieszką zanieczyszczeń, głównie związków żelaza. Dobrze rozpuszcza się w wodzie i innych rozpuszczalnikach polarnych (np. etanolu). Stężony kwas solny (38%) jest substancją silnie dymiącą na powietrzu – związek ten stale wydziela pewne ilości chlorowodoru (w ilościach proporcjonalnych do stężenia), który wskutek reakcji z wilgocią zawartą w powietrzu tworzy gęste, białe i żrące opary. Gęstość kwasu solnego jest ściśle zależna od jego stężenia – można ją w przybliżeniu określić dzieląc wartość stężenia kwasu przez dwa i zapisując otrzymany wynik po przecinku za cyfrą 1. Gęstość stężonego kwasu solnego, zwanego również kwasem solnym dymiącym (38%) wynosi więc 1,19 g/cm³, gęstość kwasu solnego 26% – 1,13 g/cm³, gęstość kwasu solnego 18% – 1,09 g/cm³, zaś gęstość kwasu solnego 10% – 1,05 g/cm³.
Temperatura wrzenia i topnienia kwasu solnego również wykazują zależność od stężenia tego związku w roztworze wodnym. Temperatura wrzenia (w temperaturze 20°C i ciśnieniu 101,325 kPa) rośnie ze spadkiem stężenia kwasu, przyjmując wartości 48°C dla kwasu 38%, 61°C dla kwasu 36%, 90°C dla kwasu 30% oraz 108°C dla kwasu 20%. Temperatura topnienia (w temperaturze 20°C i ciśnieniu 101,325 kPa) natomiast spada wraz ze spadkiem stężenia, wynosząc -26°C dla kwasu 38%, -30°C dla kwasu 36%, -52°C dla kwasu 30% i 59°C dla kwasu 20%. Roztwór wodny zawierający 20,24% chlorowodoru stanowi mieszaninę azeotropową (azeotrop) o temperaturze wrzenia 110°C, czyli mieszaninę pozostających w równowadze termodynamicznej składników ciekłych (wody i kwasu chlorowodorowego) oraz składników gazowych (pary wodnej i oparów kwasu chlorowodorowego).

Budowa i właściwości chemiczne kwasu solnego
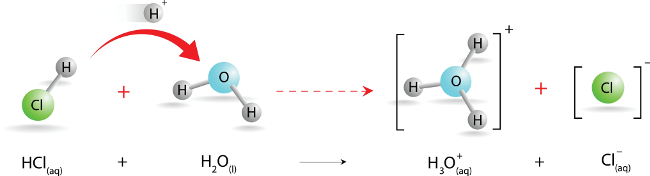
Kwas chlorowodorowy, HCl(aq), jest nieorganicznym związkiem chemicznym o masie molowej wynoszącej 36,46 g/mol, zaliczanym do grupy kwasów beztlenowych. Jest wodnym roztworem gazowego chlorowodoru, HCl(g) – prostej cząsteczki dwuatomowej składającej się z pojedynczych atomów wodoru (H) i chloru (Cl) połączonych silnie spolaryzowanym wiązaniem kowalencyjnym (atomowym) (H–Cl). Elektrony wiązania przesunięte są w stronę bardziej elektroujemnego atomu chloru o większym powinowactwie elektronowym niż atom wodoru, czego skutkiem jest obecność w cząsteczce regionu chloru z częściowym ładunkiem ujemnym (δ-) i regionu wodoru posiadającego częściowy ładunek dodatni (δ+). Chlorowodór, w związku z wysoką polarnością swej cząsteczki, bardzo dobrze rozpuszcza się w wodzie:
- rozszczepienie wiązania kowalencyjnego w cząsteczce chlorowodoru powoduje powstanie kationu wodorowego (H⁺) i anionu chlorkowego (Cl⁻):
- kation wodorowy (H⁺) ulega w wodzie hydratacji do kationu hydroniowego (oksoniowego) (H₃O⁺):
Obecność kationów hydroniowych (H₃O⁺) warunkuje kwasowy odczyn wodnego roztworu chlorowodoru, czyli kwasu chlorowodorowego.
Kwas chlorowodorowy jest jednym z najsilniejszych kwasów nieorganicznych (niska wartość pKₐ – ujemnego logarytmu dziesiętnego ze stałej dysocjacji kwasu Kₐ; pKₐ ≈ -6); cechuje się bardzo dużą aktywnością chemiczną. Rozpuszcza większość metali (z wyjątkiem metali półszlachetnych, np. miedzi oraz metali szlachetnych, np. złota, srebra) wydzielając gazowy wodór (H₂) i tworząc odpowiednie chlorki (np. chlorek sodu NaCl, chlorek magnezu MgCl₂, chlorek glinu AlCl₃):
Kwas chlorowodorowy reaguje gwałtownie z bardzo silnymi utleniaczami (np. manganianem (VII) potasu, KMnO₄), tworząc chlor cząsteczkowy (Cl₂):
Stężony kwas solny jest silnie żrącą substancją powodującą m.in. oparzenia i owrzodzenia skóry, poważne uszkodzenie oczu, podrażnienie dróg oddechowych, duszności i obrzęki płuc, w przypadku połknięcia może doprowadzić do perforacji błony śluzowej przełyku i żołądka.
Metody otrzymywania kwasu chlorowodorowego (HCl) obejmują:
- absorpcję gazowego chlorowodoru w wodzie w absorberze powierzchniowym (np. kamionkowych turylach);
- bezpośrednią syntezę, czyli spalanie wodoru (H₂) w chlorze (Cl₂) za pomocą palników kwarcowych:
- reakcję chlorków metali (np. chlorku sodu, NaCl) ze stężonym kwasem siarkowym (VI) (H₂SO₄):
I etap (w niskiej temperaturze): NaCl+H₂SO₄ → NaHSO₄+HCl
II etap (w wysokiej temperaturze): NaCl+NaHSO₄ → Na₂SO₄+HCl
- reakcję chlorowania związków organicznych (np. benzenu, C₆H₆):
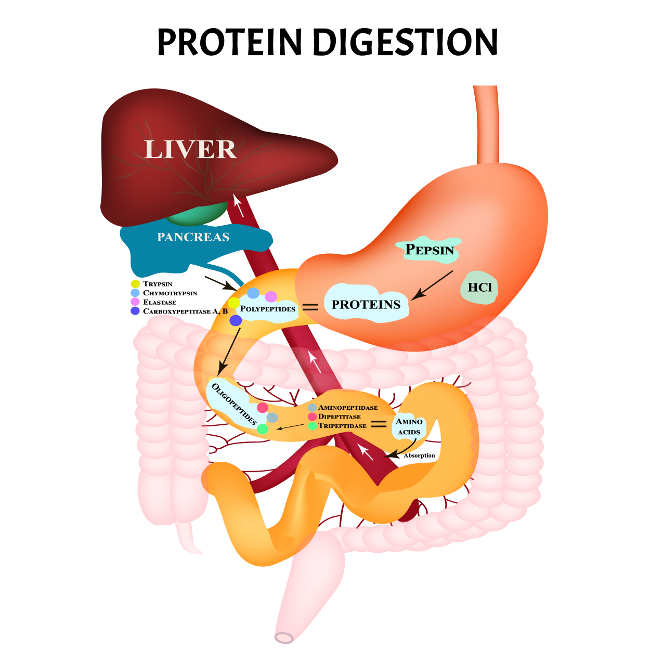
Znaczenie biologiczne kwasu solnego
Kwas solny występujący w niskich stężeniach (0,4-0,5%) w soku żołądkowym ssaków (w tym człowieka) pełni bardzo ważną rolę w procesach trawiennych zachodzących w przewodzie pokarmowym. Składniki kwasu chlorowodorowego (kationy wodoru H⁺ i aniony chlorkowe Cl⁻) produkowane są w komórkach okładzinowych gruczołów żołądkowych. Kationy wodoru (H⁺) uwalniane są do światła żołądka za pomocą pompy protonowej napędzanej przez ATP; gdzie łączą się z anionami chlorkowymi (Cl⁻) dyfundującymi przez kanały błonowe komórek okładzinowych. Powstały kwas solny (HCl) odpowiada za aktywację proteaz (czyli enzymów trawiących białka), takich jak pepsyna produkowana w postaci nieaktywnego proenzymu (pepsynogenu) przez komórki główne gruczołów żołądkowych. Niskie pH żołądka wynikające z obecności kwasu solnego powoduje denaturację białek obecnych w miazdze pokarmowej oraz wyeksponowanie ich wiązań peptydowych, dzięki czemu są następnie rozkładane przez pepsynę do krótszych łańcuchów polipeptydowych. Błona śluzowa żołądka chroniona jest przed samostrawieniem dzięki powlekającej ją warstwie śluzu wydzielanej przez trzeci rodzaj komórek występujących w gruczołach żołądkowych – komórkach śluzowych.
Zastosowania kwasu solnego
Kwas solny wykorzystywany jest powszechnie w przemyśle chemicznym do otrzymywania wielu związków chemicznych (m.in. chloru cząsteczkowego, chlorków, węglowodorów chlorowcopochodnych, nawozów mineralnych, barwnikówkatalizator i rozpuszczalnik w analizie i syntezie chemicznej. Woda królewska, mieszanina kwasu solnego(HCl) i kwasu azotowego (V) (HNO₃) (3:1), wykorzystywana jest do roztwarzania metali szlachetnych (np. złota, platyny). Przemysł farmaceutyczny wykorzystuje kwas solny głównie do syntezy aktywnych składników środków leczniczych; w przemyśle włókienniczym związek ten neutralizuje zasadowe pozostałości we włóknach i stosowany jest w procesie barwienia tkanin. Kwas solny w przemyśle spożywczym (np. cukrownictwie) jest niezbędny w produkcji glukozy, żelatyny, cukru inwertowanego oraz innych produktów skrobiowych; w browarnictwie warunkuje prawidłowy przebieg procesu warzenia piwa. Związek ten ma także zastosowanie w przemyśle tworzyw sztucznych, gdzie używany jest m.in. do wytwarzania polichlorku winylu (PCV) oraz garbarstwie do wstępnej obróbki skóry zwierzęcej. Metalurgia wykorzystuje kwas solny do ekstrakcji metali z rud.