alkohol
Alkohol – jest to związek organiczny zawierający jedną lub więcej grupę hydroksylową, czyli grupę funkcyjną (-OH), która jest związana z nasyconym węglem atomu w hybrydyzacji sp3. Pierwotnie termin alkohol odnosił się do pierwszorzędowego alkoholu etylowego stanowiącego substancję uzależniającą i będącego głównym alkoholem obecnym w napojach alkoholowych.
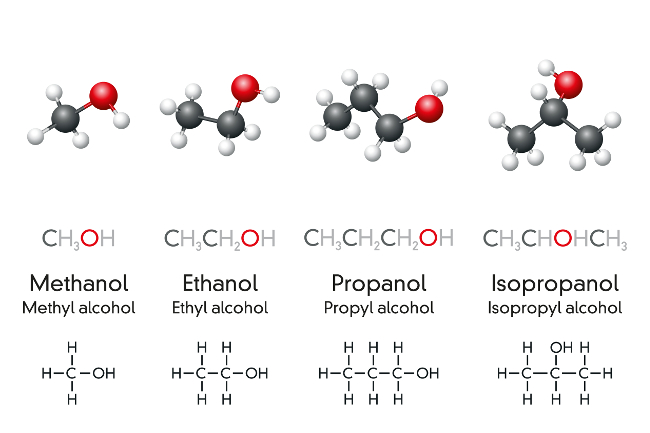
Alkohole, podobnie jak węglowodory, tworzą szeregi homologiczne. Rzędowość alkoholu jest odniesieniem do liczby (rzędowości) atomów węgla, z którym połączona jest grupa hydroksylowa. Wśród klas alkoholi do najprostszych należą metanol i etanol. Do prostych jednowodorotlenkowych (monohydroksylowych) alkoholi należą alkohole pierwszorzędowe (RCH2OH), drugorzędowe (R2CHOH) oraz trzeciorzędowe (R3COH).
Proste alkohole występują powszechnie w przyrodzie. Wśród nich etanol jest najpowszechniejszy. Bierze on udział w głównym szlaku wytwarzania energii przez komórki jako produkt procesu fermentacji. Inne proste alkohole powstają tylko w śladowych ilościach. Alkohole bardziej złożone są jednak pospolite w przyrodzie i można je znaleźć w cukrach, niektórych aminokwasach i kwasach tłuszczowych.
Proste alkohole wykazują niską toksyczność ostrą. Tolerowane dawki niektórych alkoholi to kilka mililitrów, podczas gdy metanol i etanol są mniej toksyczne. Jednak często alkohole są zanieczyszczone innymi toksycznymi substancjami. Wszystkie alkohole są łagodnie drażniącymi dla skóry substancjami. Stąd można je stosować jako główny produkt do produkcji środków do dezynfekcji. Na metabolizm metanolu wpływa obecność etanolu, który ma większe powinowactwo do dehydrogenazy alkoholowej w wątrobie. Dlatego metanol powinien zostać wydalony wraz z moczem.
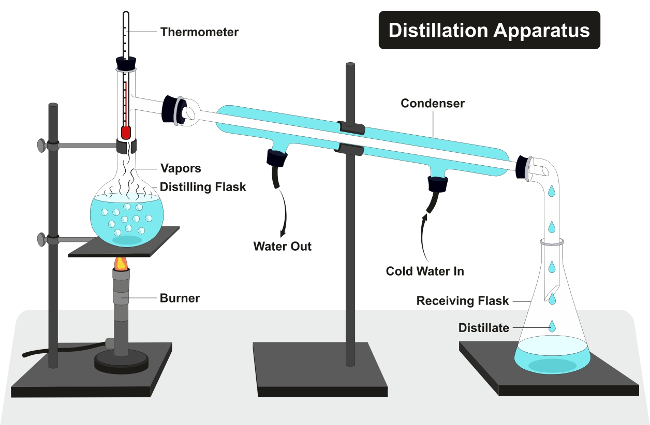
Historia alkoholu
Historia produkcji alkoholu sięga prawdopodobnie przed 2000 roku p.n.e. kiedy to cywilizacja doliny Indusu prawdopodobnie wykorzystywała destylację do jego produkcji. Proces destylacji alkoholu znany był islamskim chemikom już od VIII wieku. Do wytwarzania napojów alkoholowych zdolni byli od dawna mieszkańcy Indii. Jest to alkohol o nazwie Sura, który wytwarzany jest ze sfermentowanego ryżu, jęczmienia, cukru trzcinowego i kwiatów Madhuca longifolia. Na przykład perski lekarz Muhammad ibn Zachariasza al Razi opisał alkohol w postaci związku chemicznego. A arabski chemik al-Kindi opisał sposób destylacji wina.
Otrzymywanie alkoholu
Alkohole można otrzymywać w wyniku różnych reakcji. Wśród tych reakcji wyróżnia się hydrolizę halogenków alkilów, redukcję aldehydów czy kwasów karboksylowych (przede wszystkim wyższych kwasów tłuszczowych) prowadząc do powstawania alkoholi I-rzędowych. Reakcje redukcji estrów również prowadzą do powstania alkoholi I-rzędowych, podczas gdy reakcje redukcji ketonów prowadzą do powstania alkoholi II-rzędowych. Kolejnym sposobem otrzymywania alkoholi jest reakcja Grignarda oraz zachodząca w środowisku kwaśnym hydratacja alkenów. Istnieją jeszcze inne reakcje prowadzące do powstawania alkoholi, jak np. hydrogenację katalityczną, a także metody swoiste stosowane dla poszczególnych alkoholi.
Klasyfikacja alkoholi
Alkohole dzieli się głównie ze względu na liczbę grup wodorotlenkowych (hydroksylowych). Występuje podział na alkohole jednowodorotlenkowe oraz wielowodorotlenkowe. Do tych ostatnich zalicza się diole i cukrole. Podczas gdy do alkoholów monohydroksylowych zalicza się alkanole (np. etanol), alkenole (np. alkohol allilowy), alkinole (np. alkohol propargilowy), alkohole cykliczne (np. cykloheksanol), alkohole aromatyczne (np. alkohol benzylowy). Należy dodać, że alkohole aromatyczne różnią się nieco budową od pozostałych alkoholi, ponieważ posiadają pierścień. Jednak grupa hydroksylowa -OH znajduje się przy łańcuchu bocznym, a nie przy pierścieniu. Czasami alkohole dzieli się także na alkohole dwuwodorotlenkowe. Innym występującym podziałem jest podział ze względu na rodzaj łańcucha. W podziale tym alkohole dzieli się na nasycone i nienasycone.
Właściwości chemiczne alkoholi
Do najważniejszych reakcji alkoholi należą reakcje z metalami aktywnymi tworząc alkoholany, reakcje estryfikacji tworząc estry (czyli reakcja alkoholi z kwasami nieorganicznymi lub organicznymi), reakcje katalitycznej dehydratacji oraz reakcje utleniania, których przebieg zależy zarówno od rodzaju utleniacza jak i przede wszystkim od rzędowości alkoholu.
W przypadku utleniania alkoholi I-rzędowych dochodzi do reakcji utlenienia alkoholu I-rzędowego za sprawą np. dichromianów. Wynikiem tej reakcji są aldehydy. W reakcji tego typu wymagane jest usunięcie produktu reakcji aby zapobiec dalszej reakcji utleniania.
Ogólny wzór takiej reakcji jest następujący:
RCH2OH + Cr2O2−7 → RCHO + Cr3+
Innym utleniaczem może być chlorochromian pirydyny (PCC), który niweluje potrzebę zastopowania dalszego utleniania, a przy tym reakcja zachodzi wydajniej. W reakcji utleniania można uzyskiwać różne produkty, a wśród nich m.in. kwasy karboksylowe. Przykładem otrzymywania takiego związku jest reakcja nadmanganianu potasu i tlenku chromu (VI) w środowisku kwaśnym. Przykładowy wzór takiej reakcji jest następujący:
RCH2OH + KMnO4 → RCOOK + MnO2 + KOH
Utlenianie alkoholi II-rzędowych prowadzić może do powstania ketonów. Przykładową reakcją utleniania alkoholi II-rzędowych może być wykorzystanie nadmanganian potasu jako utleniacza. W wyniku tej reakcji dochodzi nawet do rozerwania wiązania C–C. Innym przykładem reakcji utlenianie alkoholi tego rzędu jest wykorzystanie w roli utleniacza dichromianów, a reakcja musi przebiegać w środowisku kwaśnym. Przykładowy wzór takiej reakcji jest następujący:
R2CHOH + Cr2O2−7 → R2CO + Cr3+
Alkohole III-rzędowe poddane reakcji utleniania w środowisku zasadowym z wykorzystaniem takich utleniaczy jak K2Cr2O7 czy KMnO4 nie reagują. Jednak w środowisku kwaśnym alkohole tego rzędu ulegają dehydratacji do alkenów i reakcjom dalszego rozkładu.

Właściwości fizyczne alkoholi
Rozpuszczalność alkoholi zależna jest od ich rzędowości. Alkohole wyższe najlepiej rozpuszczają się w rozpuszczalnikach niepolarnych, podczas gdy alkohole niższe najlepiej rozpuszczają się w rozpuszczalnikach polarnych. Ponadto alkohole wyższe wykazują właściwości fizyczne zbliżone do alkanów pod warunkiem posiadania podobnych mas molowych. Obecność silnie elektroujemnego atomu tlenu i związanego z nim atomu wodoru w alkoholach determinuje ich inne właściwości fizyczne. Alkohole ulegają dysocjacji w większe struktury i mają zdolność do tworzenia wiązań wodorowych. Ponadto posiadają małą lotność względem swojej masy oraz wysokie temperatury wrzenia. Na przykład temperatura wrzenia dla metanolu to 65 °C, dla etanolu to 79 °C, dla propan-1-olu to 97 °C, a dla propan-2-olu to 82 °C.
Zastosowanie alkoholu
Alkohole posiadają ogromnie dużo zastosowań. Alkohole jednowodorotlenkowe są wykorzystywane najczęściej. W przypadku tych prostych monohydroksylowych alkoholi wykorzystywanych przemysłowo wyróżnia się następujące zastosowania:
- metanol stosowany jest głównie do produkcji formaldehydu oraz jako dodatek do paliw
- Etanol stosowany jest głównie do produkcji napojów alkoholowych, ale także jako dodatek do paliw, czy też jako rozpuszczalnik;
- 1-propanol, 1-butanol i alkohol izobutylowy stosowane są jako rozpuszczalniki oraz jako prekursory rozpuszczalników;
- Alkohole C6 – C11 wykorzystywane są w charakterze plastyfikatorów m.in. w polichlorku winylu
- Alkohole C12 – C18 wykorzystywane są jako prekursory detergentów.






