estry
Estry – związki organiczne otrzymywane w wyniku reakcji alkoholi lub fenoli z kwasami karboksylowymi (np. kwasem octowym) lub kwasami mineralnymi (kwasem azotowym (V), kwasem siarkowym (VI), kwasem fosforowym), czyli estryfikacji katalizowanej przez mocne kwasy nieorganiczne (np. stężony kwas siarkowy, bezwodny chlorowodór, kwasy sulfonowe). Estry o niskiej masie cząsteczkowej są bezbarwnymi, lotnymi cieczami o owocowym zapachu; estry o większej masie cząsteczkowej są bezwonnymi ciałami stałymi. Są słabo rozpuszczalne w wodzierozpuszczalnikach organicznych. Estry są reaktywne chemicznie – ulegają hydrolizie w środowisku kwasowym i zasadowym, redukcji do alkoholi, kondensacji Claissena, aminolizie i transestryfikacji. Są szeroko rozpowszechnione w świecie roślinnym i zwierzęcym (np. olejki eteryczne, tłuszcze, woski, fosforany cukrów, nukleotydy, kwasy nukleinowe). Stosowane są jako składniki kompozycji zapachowych, rozpuszczalniki oraz rozcieńczalniki farb i lakierów, plastyfikatory tworzyw sztucznych i żywic syntetycznych, substancje lecznicze, materiały wybuchowe oraz środki owadobójcze (insektycydy).
Występowanie i funkcje biologiczne estrów
Estry są szeroko rozpowszechnione zarówno w świecie roślinnym, jak i zwierzęcym. Estry niskocząsteczkowych kwasów karboksylowych i alkoholi są składnikami olejków eterycznych nadających zapach kwiatom, owocom lub liściom roślin olejkodajnych. Olejki bogate w estry pozyskiwane są m.in. z owoców bergamoty (olejek bergamotowy), świeżych kwiatów i liści lawendy (olejek lawendowy), igieł sosny (olejek sosnowy) i kwiatów pomarańczy gorzkiej (olejek neroli). Estry wyższych kwasów tłuszczowych i glicerolu (triacyloglicerole) stanowią substancje zapasowe komórek roślinnych i zwierzęcych. Woski, czyli estry wyższych kwasów karboksylowych i wyższych alkoholi monowodorotlenowych lub steroli, pełnią rolę ochronną (np. woskowa kutykula roślin, woskowa wydzielina gruczołów łojowych zwierząt). Niektóre owady (pszczoły, osy, trzmiele) wykorzystują woski do budowy gniazda (np. wosk pszczeli)
Estry kwasu fosforowego (V), w szczególności estry fosforanowe cukrów (glukozo-6-fosforan, glukozo-1-fosforan, rybulozo-1,5-bisfosforan) pełnią istotną funkcję w licznych przemianach metabolicznych zachodzących w organizmach roślinnych i zwierzęcych (np. glikolizie, cyklu pentozowym, cyklu Calvina-Bensona, glukoneogenezie). Do estrów kwasu fosforowego (V) należą również nukleotydy pełniące rolę przenośników energii (NADP, ATP) oraz nukleotydy budujące kwasy deoksyrybonukleinowe (DNA) zawierające informację genetyczną organizmu (kod genetyczny) oraz kwasy rybonukleinowe (RNA) uczestniczące w biosyntezie białka. Estry kwasu siarkowego (VI) i cukrów złożonych (polisacharydów) (tzw. glikozaminoglikany, GAG) są składnikami strukturalnymi (budulcowymi) organizmów zwierzęcych wchodzącymi w skład błony komórkowej, macierzy pozakomórkowej oraz tkanki łącznej.

Właściwości fizyczne estrów
Estry proste, czyli estry kwasów karboksylowych i alkoholi alifatycznych o niskich masach cząsteczkowych, są bezbarwnymi, lotnymi cieczami o niskiej temperaturze wrzenia (niższej niż temperatura wrzenia odpowiednich kwasów karboksylowych) oraz stosunkowo wysokiej łatwopalności. Estry niskocząsteczkowe są słabo rozpuszczalne w wodzie; mieszają się z nią tylko w niewielkim stopniu dzięki obecności wiązań wodorowych tworzących się pomiędzy cząsteczkami wody oraz grupą funkcyjną współtworzącego je kwasu karboksylowego (grupą karboksylową). Estry stosunkowo dobrze rozpuszczają się w rozpuszczalnikach organicznych.
Estry proste są cieczami o charakterystycznym, owocowym lub kwiatowym zapachu:
- mrówczan etylu (ester etylowy kwasu mrówkowego) – zapach rumu;
- mrówczan izobutylu (ester izobutylowy kwasu mrówkowego) – zapach malin;
- octan benzylu (ester benzylowy kwasu octowego) – zapach jaśminu;
- octan bornylu (ester borneolowy kwasu octowego) – zapach igieł sosnowych;
- octan geranylu (ester geranylowy kwasu octowego) – zapach róży, pelargonii;
- octan izobutylu (ester izobutylowy kwasu octowego) – zapach bananów;
- octan linalilu (ester linalolowy kwasu octowego) – zapach lawendy, szałwii;
- octan oktylu (ester oktylowy kwasu octowego) – zapach pomarańczy;
- maślan etylu (ester etylowy kwasu masłowego) – zapach ananasów;
- maślan izoamylu (ester izopentylowy kwasu masłowego) – zapach gruszek;
- maślan metylu (ester metylowy kwasu masłowego) – zapach jabłek;
- antranilan metylu (ester metylowy kwasu antranilanowego) – zapach winogron;
- salicylan metylu (ester metylowy kwasu salicylowego) – zapach korzenny.
Woski, czyli estry wyższych kwasów karboksylowych i wyższych alkoholi lub steroli, są ciałami stałymi o gęstej konsystencji, pozbawionymi zapachu. Estry wyższych kwasów tłuszczowych i glicerolu (tłuszcze) w zależności od rodzaju kwasów tłuszczowych wchodzących w skład ich cząsteczki są cieczami oleistymi (kwasy nienasycone, np. kwas oleinowy) lub ciałami stałymi (kwasy nasycone, np. kwas palmitynowy). Woski i tłuszcze są nierozpuszczalne w wodzie ze względu na duży udział części hydrofobowej (długie łańcuchy węglowe kwasów i alkoholi); stosunkowo dobrze rozpuszczają się w niepolarnych rozpuszczalnikach organicznych.
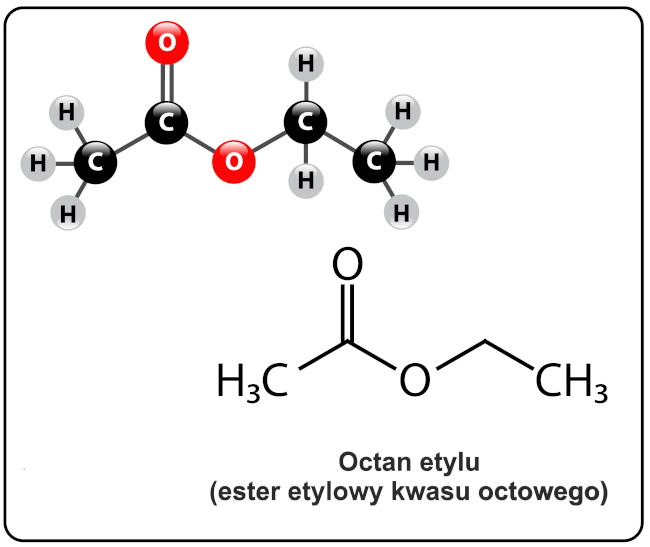
Otrzymywanie estrów (reakcja estryfikacji)
Estry (niem. Essigäther – eter octowy, octan etylu) stanowią grupę związków organicznych otrzymywanych w wyniku reakcji alkoholi lub fenoli z kwasami karboksylowymi (np. kwasem octowym, kwasem masłowym, kwasem palmitynowym) lub kwasami nieorganicznymi (mineralnymi) (np. kwasem azotowym (V), kwasem siarkowym (VI), kwasem ortofosforowym (V)), czyli reakcji estryfikacji katalizowanej przez mocne kwasy nieorganiczne (np. stężony kwas siarkowy, bezwodny chlorowodór, kwasy sulfonowe, kwasowe wymieniacze jonowe).
Estry azotanowe (tzw. azotany alkilów, R–O–NO₂) otrzymuje się w wyniku reakcji alkoholu (R–OH) z kwasem nieorganicznym (kwasem azotowym (V), HNO₃):
R–OH + HO–NO₂ ⇄ R–O–NO₂ + H₂O
Główną metodą otrzymywania estrów są jednak reakcje kwasów karboksylowych (R1–COOH) z alkoholami (R₂–OH) (tzw. alkoholiza kwasów karboksylowych), zachodzące w środowisku kwaśnym, które można zapisać za pomocą równania:
R1–COOH + R₂–OH ⇄ R₁–COO–R₂ + H₂O
gdzie:
R₁ – łańcuch węglowy pochodzący od kwasu karboksylowego;
R₂ – łańcuch węglowy pochodzący od alkoholu.
Wydajność reakcji estryfikacji można efektywnie zwiększyć dzięki wykorzystaniu środków przesuwających stan równowagi reakcji w prawo (wynikających z reguły Le Chateliera), m.in. oddestylowania estru, wiązania wody (np. za pomocą stężonego kwasu siarkowego (VI) lub użycia nadmiernej ilości kwasu karboksylowego lub alkoholu.
Właściwości chemiczne estrów
Estry wykazują dużą reaktywność chemiczną – ulegają hydrolizie w środowisku kwasowym lub zasadowym, redukcji do alkoholi pierwszorzędowych (katalityczne uwodornienie), acylowaniu związkami karbonylowymi, np. aldehydami, ketonami (kondensacja Claissena), reakcji z aminami z wytworzeniem amidów kwasowych (aminoliza) oraz reakcji z alkoholami, kwasami lub innymi estrami z wytworzeniem estrów (transestryfikacja).
Hydroliza estrów zachodząca w środowisku kwasowym (hydroliza kwasowa) jest reakcją odwrotną do estryfikacji, prowadzącą do powstania kwasu karboksylowego i alkoholu:
R₁–COO–R₂ + H₂O ⇄ R1–COOH + R₂–OH
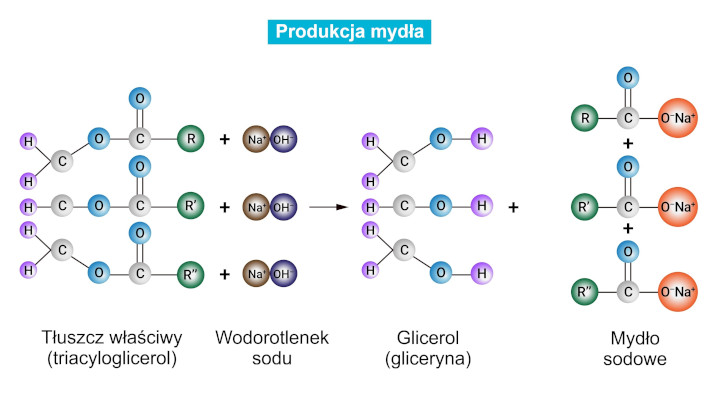
Hydroliza estrów zachodząca w środowisku zasadowym (np. w obecności wodorotlenku sodu, NaOH) (hydroliza zasadowa, zmydlanie, saponifikacja) jest reakcją nieodwracalną prowadzącą do powstania soli sodowej kwasu karboksylowego i alkoholu:
R₁–COO–R₂ + NaOH ⇄ R1–COONa + R₂–OH
Zmydlanie estrów wyższych nasyconych kwasów tłuszczowych (np. kwasu palmitynowego, kwasu stearynowego) i glicerolu (tzw. zmydlanie tłuszczów) wykorzystywane jest głównie do produkcji mydeł (np. palmitynianu sodu, stearynianu potasu); reakcja hydrolizy zasadowej estrów stosowana jest również do ilościowego oznaczania tych związków chemicznych.
Reakcja transestryfikacji (np. alkoholiza estrów) polega na wymianie łańcucha węglowego pochodzącego od alkoholu estru wyjściowego (R₂) na łańcuch węglowy reagującego z nim alkoholu (np. metanolu, CH₃OH), co prowadzi do powstania nowego estru:
R₁–COO–R₂ + CH₃OH → R₁–COO–CH₃ + R₂–OH
Transestryfikacja estrów wykorzystywana jest w syntezie poliestrów, m.in. politereftalanu etylenu (PET) otrzymywanego w wyniku reakcji tereftalanu dimetylu z glikolem etylenowym w obecności katalizatorów (np. cynku). Zwiększenie wydajności procesu osiąga się przez zastosowanie nadmiaru jednego z substratów bądź destylację lotnych produktów reakcji.
Zastosowania estrów
Estry wykorzystywane są powszechnie jako rozpuszczalniki i rozcieńczalniki farb i lakierów (np. octan etylu, octan butylu) oraz plastyfikatory tworzyw sztucznych i żywic syntetycznych (np. estry kwasu ftalowego i fosforowego). Lotne estry pozyskiwane z olejków eterycznych (np. octany bornylu, geranylu, linalilu i benzylu) stanowią składniki kompozycji zapachowych stosowanych w przemyśle perfumeryjnym i kosmetycznym (np. produkcja mydeł i płynów do kąpieli), przemyśle farmaceutycznym (np. aromatyzowanie maści leczniczych) i spożywczym (np. produkcja aromatów spożywczych, aromatyzowanie herbaty). Woski naturalne używane są do produkcji świec, past do butów i podłóg oraz nabłyszczaczy do karoserii samochodowej (np. wosk pszczeli, wosk karnauba, kandelila). Niektóre olejki eteryczne (np. olejek sosnowy bogaty w octan bornylu) i woski (np. wosk pszczeli) mają zastosowanie w lecznictwie.
Estry kwasu siarkowego (VI) stanowią ważne odczynniki alkilujące w reakcjach metylowania (siarczan dimetylu) i etylowania (siarczan etylu) wykorzystywanych w przemyśle chemicznym do wytwarzania barwników i półproduktów chemicznych oraz przemyśle farmaceutycznym do produkcji substancji leczniczych. Estry azotanowe, np. triazotan glicerolu i nitroceluloza (mieszanina estrów celulozy i kwasu azotowego) mają zastosowanie w produkcji materiałów wybuchowych (np. dynamitu, prochów bezdymnych, żelatyny wybuchowej). Estry kwasu ortofosforowego wykorzystywane są w charakterze środków owadobójczych (insektycydów). Polimery estrów (poliestry) stosowane są do produkcji żywic lakierniczych (poliestrowych), włókien syntetycznych, folii i butelek plastikowych (politereftalan etylenu, PET), substytutów szkła (polimetakrylan metylu), klejów do drewna i farb emulsyjnych (polioctan winylu).






